Cardiothoracic Anaesthesia
QUESTIONS
Avant de continuer, essayez de répondre aux questions suivantes. Les réponses et des explications se trouvent à la fin de l’article. Répondre par Vrai ou Faux:
- En ce qui concerne la sténose aortique:
- C’est l’une des causes les plus fréquentes de maladies valvulaires dans les pays développés.
- Elle est présente chez jusqu’à 30% des adultes de plus de 65 ans.
- La maladie cardiaque rhumatismale est la principale cause de sténose aortique dans les pays développés
- Elle est dite sévère lorsque l’aire valvulaire est moins de 1 cm2.
- La sténose aortique combinée à l’insuffisance cardiaque congestive (ICC) a une mortalité de 50% à 2 ans.
- Concernant le traitement de la sténose aortique:
- Les nitrates sont en général contrindiqués.
- L’angine est traitée avec des beta-bloqueurs ou des antagonistes des canaux calciques.
- Les statines réduisent la fréquence des événements ischémiques cardiovasculaires chez les patients âgés.
- La digitale ou les diurétiques ne sont plus utilisés dans le traitement de l’ICC associée.
- L’ICC associée avec la sténose est traitée avec un inhibiteur de l’enzyme de conversion de l’angiotensine.
- Concernant la gestion périopératoire de l’IVAP:
- Le monitoring invasif devrait être installé avant l’induction de l’anesthésie.
- La fibrillation auriculaire est habituellement bien tolérée.
- Les patients sont dépendants de la pré-charge.
- L’hypotension devrait être traitée agressivement.
- En cas d’arrêt cardiaque, la réanimation cardio-respiratoire a de bonnes chances d’être efficace.
Points Essentiels
- Si la valve n’est pas remplacée, la sténose aortique symptomatique a un mauvais pronostic.
- En raison des comorbidités et du risque élevé de mortalité, le patient âgé est souvent jugé inapte à la chirurgie pour remplacement valvulaire.
- Les techniques minimalement invasives par cathéter se sont rapidement développées et ont élargi les indications permettant d’offrir un traitement aux patients à haut risque.
- Les considérations anesthésiques et les techniques pour l’IVAT sont semblables à celles employées pour d’autres procédures minimalement invasives effectuées dans des salles d’opérations hybrides.
INTRODUCTION
La sténose aortique, qui est un rétrécissement progressif de la valve aortique, est l’un des problèmes valvulaires les plus courants dans les pays développés où la principale cause est la maladie cardiaque rhumatismale1. Elle peut demeurer asymptomatique sur une période prolongée et être présente chez jusqu’à 25% des adultes de plus de 65 ans1. Les conséquences hémodynamiques majeures surviennent avec une aire valvulaire de moins de 1-1.5 cm2 2.
Ce sont la surface valvulaire et le gradient de pression moyen qui déterminent la sévérité. Légère à >1.5cm2 et < 25mmHg. Modérée à 1-1.5cm2 et 25-40mmHg. Sévère à < 1 cm2 et >40mmHg. Très sévère à < 0.6cm2 et gradient à plus de 70mmHg3.
La progression de la maladie cause une surcharge en pression du ventricule gauche qui mène à une hypertrophie concentrique de la paroi ventriculaire. Des pressions intra-ventriculaires élevées sont requises pour maintenir le débit cardiaque alors qu’une dysfonction systolique et diastolique apparaîtra éventuellement sur fond de post-charge augmentée et de contractilité diminuée 2. Une dyspnée à l’effort, la syncope et l’angine forment la triade classique, mais la syncope et l’insuffisance cardiaque sont signes de mauvais pronostic 3.
Le but du traitement médical est de cibler la maladie coronarienne coexistante et l’hyperlipidémie pour contrôler l’angine, l’hypertension et la défaillance cardiaque, mais on n’a pas démontré que cela améliore la survie. L’emploi des statines vise à prévenir les événements cardiovasculaires ischémiques. L’angine et l’hypertension sont traités avec des βbloqueurs ou des bloqueurs des canaux calciques. Pour l’insuffisance cardiaque, on donne généralement de la digitale ou des diurétiques. Les inhibiteurs de l’enzyme de conversion de l’angiotensine sont utilisés avec précaution une fois qu’on a éliminé une obstruction au débit, alors qu’on évite en général les nitrates en raison du potentiel d’hypotension excessive et imprévisible. Sans intervention chirurgicale ou endovasculaire, le taux de survie à 1 an de la sténose aortique sévère est de 50-60% 3.
Le remplacement chirurgical de la valve aortique (RCVA) est considéré comme le traitement de choix. Il améliore la qualité de vie et la survie. La mortalité intra-hospitalière et à 30 jours pour la RCVA est basse à 3,2%, avec une espérance de vie après la procédure presque comparable à une population contrôle2, 4.
En 2003, l’Enquête Européenne sur les maladies valvulaires cardiaques révélait que 31.8% des patients n’avaient pas pu subir une intervention chirurgicale en raison de comorbidités5. La dysfonction ventriculaire gauche, la sténose aortique sévère et l’âge du patient sont des caractéristiques prédominantes de ce groupe malgré un taux de survie rapporté comme bon chez les patients âgés de 79 ans et plus5.
Dans le traitement de la sténose aortique sévère, l’implantation de la valve aortique par voie percutanée (IVAP) et la valvuloplastie aortique par ballonnet (VAB) sont des techniques moins invasives ayant chacune des bénéfices à court et long terme.
La première VAB fut faite en 1983. Malheureusement, avec cette technique, de hauts taux de re-sténose furent rapportés. En 2002, à l’Université de Rouen en France, le Docteur Alain Cribier effectua la première implantation de valve aortique par voie percutanée sur un patient de 57 ans ayant une sténose aortique inopérable6.
A l’instar d’autres techniques percutanées comme l’endoprothèse pour l’anévrisme de l’aorte abdominale, l’IVAP est souvent le premier choix chez les patients jugés à haut risque opératoire ou quand la chirurgie est contrindiquée. Dans une revue de cas en 2011, on estimait à 16,4% la mortalité pour la RCVA chez une population à plus haut risque7. Ces patients avaient un score de 10 ou plus sur l’échelle STS-PROM de la Society of Thoracic Surgeons (USA). Chez des patients ayant un risque comparable, la mortalité à l’hôpital après IVAP était de 7,4%8.
En 2011-12, l’étude européenne PARTNER révélait que l’IVAP était au moins aussi bonne et possiblement meilleure que le RCVA chez le patient à haut risque et qu’elle devrait être le traitement de choix chez le patient inopérable. Dépendant de l’approche utilisée pour l’IVAP, des différences significatives de mortalité ont été rapportées (trans-fémoral 5.9%, trans-apical 12.9% and trans-sous-clavière, 9.7%) 8.
Depuis les dernières années, les techniques par cathéter endovasculaire sont devenues l’option de choix pour le traitement de la sténose aortique chez le patient à haut risque ou inopérable. Plus de 200,000 implants aortiques ont été installés dans le monde jusqu’à présent avec de bons résultats en comparaison avec le RCVA9. Les taux de succès pour la procédure sont de 98%, avec une mortalité à 30 jours à moins de 5%. L’amélioration des symptômes et une réduction du temps d’hospitalisation sont aussi rapportés tout de suite après la procédure10,11.
La technologie du dispositif continue de s’améliorer et les défis techniques initiaux ont été surmontés. Plusieurs types de valves sont utilisés pour l’IVAP, mais la valve Edwards SAPIEN valve (figure 1) et la Medtronic CORE (Figure 2) dominent le marché. Les valves sont présentement de deuxième génération et on espère voir diminuer les complications associées. Les indications se font plus larges, quelques études à petite échelle démontrant un futur rôle chez des patients avec une régurgitation aortique pure ou ceux ayant une bio-prothèse défaillante non-propice à une reprise de la chirurgie cardiaque6.
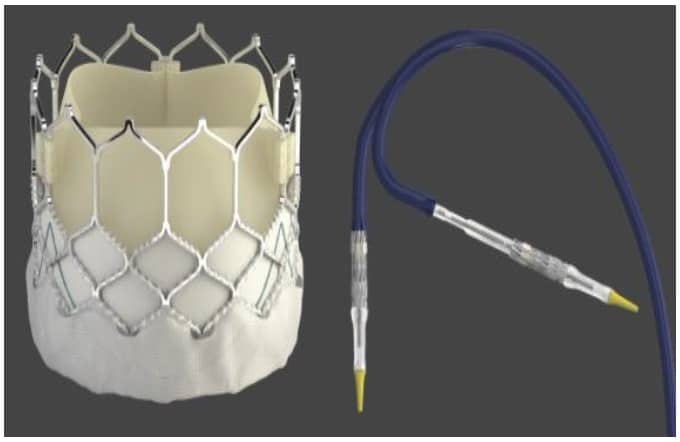
Figure 1. Valve Edwards SAPIEN 3 avec système de mise en place. Reproduit avec l’autorisation de Edwards Life Sciences.
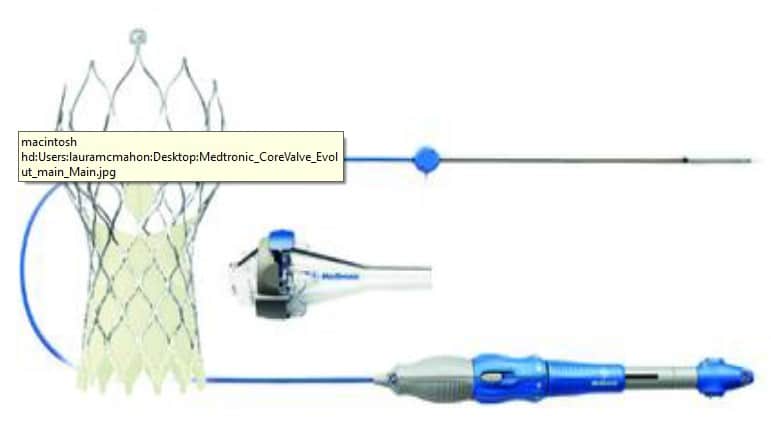
Figure 2. Medtronic Core Valve Evolut R avec sytème de mise en place. Reproduit avec l’autorisation de Medtronic.
On note une tendance récente à offrir l’IVAP à des patients plus jeunes ou à moins haut risque. Dans l’étude NOTION (The Nordic Aortic Valve Intervention Trial), on a comparé tous les RCVA et les IVAP, y compris chez les patients à risque faible12. Les résultats étaient meilleurs avec IVAP vs RCVA mais l’étude n’avait pas la puissance nécessaire pour montre un bénéfice sur la mortalité12. Comme avec toute nouvelle procédure, les résultats à long terme sont inconnus et la durée de vie de la valve reste à déterminer.
Ce tutoriel vise à revoir les considérations anesthésiques et la gestion des patients pour une procédure d’IVAP.
INDICATION ET ÉVALUATION DU RISQUE
Les patients sont choisis pour une IVAP par une équipe multidisciplinaire composée du cardiologue, du chirurgien cardio-thoracique et de l’anesthésiste sur la base du jugement clinique et de l’évaluation du risque. Les énoncés de position de l’Association Européenne de Chirurgie Cardio-thoracique (EACTS) et de la Société Européenne de Cardiologie (ESC) stipulent que l’IVAP est en ce moment restreint aux patients à risque élevé et à ceux pour qui la chirurgie est contrindiquée13.
L’IVAP ou la VAB peuvent être faits comme procédures de relais pour stabiliser un patient en vue d’une future réparation chirurgicale. L’IVAP peut être utilisée pour faciliter un pontage aorto-coronarien ou comme traitement pour une défaillance d’une bio-prothèse installée chirurgicalement. Les guides de pratique de la Société Européenne d’Anesthésiologie (ESA) et de l’ESC stipulent que l’IVAP peut être envisagée chez les patients avec sténose aortique sévère pour qui l’approche chirurgicale n’est pas appropriée mais qui doivent par ailleurs subir une chirurgie noncardiaque urgente13. Cette conduite pourrait être appropriée pour un patient qui doit subir une chirurgie curative pour cancer si un minimum de 1 an de survie est prédit. Une sternotomie antérieure n’est pas une contrindication et en fait, l’IVAP pourrait être préférable chez les patients avec pontages perméables. Les patients avec des atteintes significatives des systèmes rénal, pulmonaire ou autre qui ont été refusés pour la chirurgie pourraient aussi bénéficier.
Il existe un certain nombre de contrindications pour cette procédure. Certaines sont relatives et sujettes à réévaluation en fonction de l’amélioration dans les techniques, l’expérience et les avancées dans la technologie des valves.

L’inclusion de la régurgitation mitrale (RM) et de la dialyse chronique dans les contrindications absolues fait l’objet d’un débat. Une analyse portant sur 316 patients ayant subi une IVAP dans un centre du Royaume Uni entre 2008 et 2013 a montré qu’une RM importante était associé de façon indépendante à une mortalité accrue toutes causes confondues après l’IVAP14. Cependant, la même étude montrait une amélioration significative de la sévérité de la RM post-IVAP avec un taux de mortalité plus bas que celui de patients similaires traités médicalement pour la RM14. L’étude montrait que les patients avec RM fonctionnelle avaient tendance à mieux faire. Les résultats défavorables semblent associés avec la RM organique accompagnée d’une fibrillation auriculaire et d’une hypertension pulmonaire15. Présentement, l’attention se porte sur l’évaluation de la sévérité de la RM et de son étiologie en relation avec d’autres comorbidités avant la procédure pour aider à planifier une gestion efficace du patient.
Les auteurs d’un article publié en 2012 ne pouvaient trouver aucune raison pour ne pas offrir une IVAP aux patients dialysés15. Chez ces patients, la durée d’hospitalisation tendait à être plus longue, le but étant de préserver la fonction rénale préexistante chez ceux ayant une maladie rénale chronique grade 3 ou 4. Une thérapie de support de la fonction rénale avec participation active du néphrologue durant la période péri-opératoire est essentielle chez les patients dépendants de la dialyse15.

En préopératoire, la sévérité de la sténose et la présence d’accès vasculaires adéquats peuvent être étudiés par l’échographie trans-thoracique ou transoesophagienne et les tests de tolérance à l’exercice16. La dimension requise de la prothèse et la sévérité de la maladie sont mesurés de façon appropriée par l’aortographie, l’IRM ou le CT16. Tous les efforts doivent être faits pour identifier les maladies intercurrentes et la défaillance cardiaque associées et optimiser le patient.
PLANIFICATION DE LA PROCÉDURE
L’IVAP est communément effectuée via 4 accès: trans-fémoral, trans-sous-clavier, trans-aortique et trans-apical. L’accès trans-carotidien a été récemment décrit dans la littérature comme une alternative lorsque les autres accès vasculaire sont difficiles mais il est assez rarement utilisé17. Chacun des accès comporte son lot de défis. Il n’y a pas d’évidence montrant la supériorité d’une approche sur les autres et il n’existe aucune recommandation sur le choix du site d’accès17. Une approche individuelle du patient est importante et se base sur une évaluation minutieuse par le CT de la distribution du calcium au niveau des sites d’accès de même que dans l’aorte ascendante17.
- L’approche trans-fémorale est la moins invasive et la plus communément utilisée. Les vaisseaux ilio-fémoraux doivent mesurer 7 mm ou plus avec calcifications et tortuosité minimales16.
- La trans-sous-clavière offre un accès moins éloigné de la valve aortique. La gauche est préférable à la droite. La distance au site d’implantation ainsi que le cathéter sont plus courts – on évite la courbure dans l’axe ilio-fémoral et dans l’aorte thoraco-abdominale. Cela améliore le contrôle lors du déploiement et favorise un positionnement plus précis, ce qui pourrait aider à réduire l’incidence des fuites para-valvulaires et des blocs de conduction complets18.
- Les approches trans-aortique ou aortique directe sont plus invasives et se font via une mini sternotomie haute en J19. Elles sont indiquées quand l’accès ilio-fémoral est impossible ou quand la route trans-apicale est contre-indiquée en raison d’une fonction ventriculaire gauche trop diminuée.
- La trans-apicale est la plus invasive : elle évite les vaisseaux artériels. Les risques tels la rupture de l’oreillette, le pseudoanévrisme ventriculaire, la détérioration de la fonction du ventricule gauche, le saignement péri-opératoire et les complications respiratoires liées à la thoracotomie augmentent de façon significative19. L’accès trans-apical est utile en présence d’une aorte de porcelaine alors qu’une approche trans-aortique est contrindiquée. Les avantages incluent un accès direct et non limité avec une distance plus courte et une implantation antérograde qui facilite un positionnement précis17.
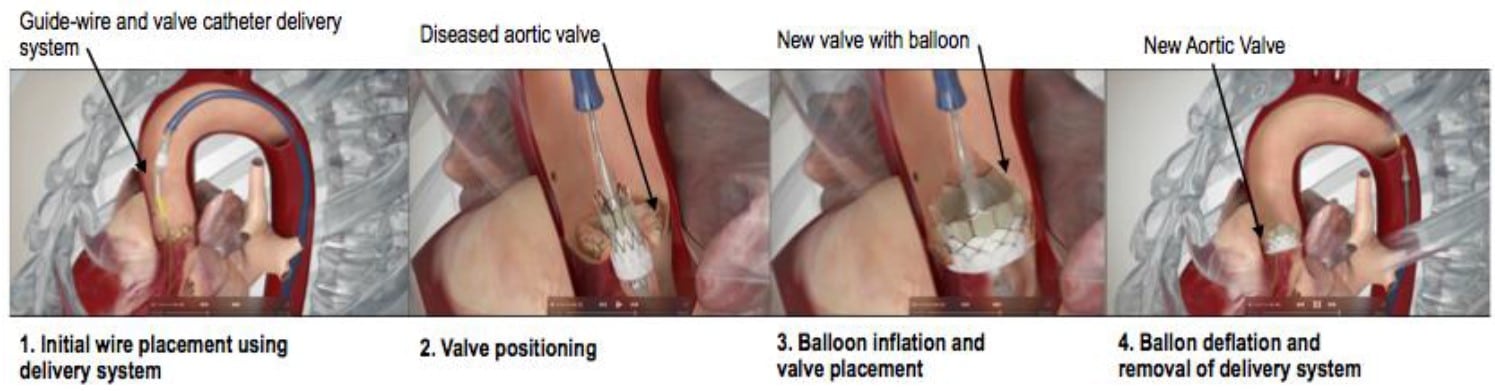
Figure 3. Illustration de la procédure IVAP. Approche fémorale avec la valve Edwards SAPIEN 3 Reproduit avec la permission de Edwards Life sciences
Les résultats avec une approche trans-apicale sont souvent moins bons qu’avec une approche trans-fémorale avec en plus un risque accru d’événements indésirables. Cela pourrait être une conséquence des comorbidités plus importantes qui rendent cette approche nécessaire et de la nature plus invasive de la procédure2.
Il est essentiel d’avoir un plan d’intervention pour les évènements imprévus et de discuter et documenter à l’avance les difficultés éventuelles lors d’une réanimation. Ces stratégies seront revues lors du temps d’arrêt pour la liste de contrôle chirurgicale de l’Organisation Mondiale de la Santé. L’IVAP est faite en salle de cathétérisme cardiaque ou encore, idéalement, dans une salle d’opération hybride16,19. L’environnement peut être hostile, l’accès au patient étant difficile, partagé entre plusieurs intervenants et requérant vigilance et organisation. Les patients peuvent subir des complications sérieuses telles une hémorragie majeure, une rupture apicale ou un arrêt cardiaque. Il faut planifier un éventuel accès fémoral d’urgence pour une circulation extracorporelle, une défibrillation ou une stimulation cardiaque avec intervention chirurgicale si nécessaire16,19.
Le chirurgien cardio-thoracique et le perfusioniste doivent être immédiatement disponibles. La préparation pour la gestion du cas doit inclure les considérations suivantes:
- Hémodynamie: Penser aux vasopresseurs, agents inotropes, stimulateur et défibrillateur4, 16,19.
- Anticoagulation: Un ACT de plus de 250 secondes est habituellement requis. Les patients continuent de prendre aspirine et clopidogrel avant la procédure sur la base des indications cliniques4, 16,19.
- Monitorage: Monitorage invasif avec échographie transoesophagienne et Swan-Ganz si nécessaire4, 16,19. Chez les patients éveillés on utilise l’écho transthoracique.
- Circulation extra-corporelle: Prévoir une CEC fémoro-fémorale surtout chez les patients ayant une fraction d’éjection de moins 20%19.
- Exposition à la radiation: On doit utiliser de l’équipement fluoroscopique de haute qualité. Tous les intervenants doivent être protégés et on doit prendre toutes les mesures nécessaires pour éviter chez le patient les atteintes rénales secondaires aux produits de contraste4, 16,19.
GESTION PERIOPÉRATOIRE
Avant l’induction, il faut installer le monitorage de base pour l’anesthésie, soit l’ECG et la saturométrie, pression artérielle non-invasive et sonde pour la température. L’utilisation de monitorage invasif avant l’induction est laissée au jugement du clinicien. Les points 1 et 2 sont recommandés; les points 3 à 5 sont décidés au cas par cas. Le cathéter de l’artère pulmonaire et le dispositif d’assistance ventriculaire pourraient n’être utiles que chez les patients à haut risque.
- Accès veineux périphérique de haut calibre- avec infuseur rapide pour perte sanguine rapide.
- Ligne artérielle pour réagir rapidement aux changements hémodynamiques.
- Voie centrale pour administrer les vasopresseurs ou les inotropes.
- Un introducteur pour cathéter de l’artère pulmonaire ou stimulateur cardiaque temporaire. Aussi utile comme voie d’infusion rapide16, 19.
- Dispositif d’assistance ventriculaire percutané pour soutenir la fonction si la défaillance cardiaque devenait significative16.
Pour ce qui est des buts hémodynamiques, initialement, on devrait viser à maintenir la précharge, la pression systolique et un temps diastolique adéquat. Le rythme sinusal est idéal, avec une cible de 80 par minute et une contractilité adéquate. Une fibrillation auriculaire de novo étant mal tolérée, un bon contrôle du rythme est requis. Pour y arriver, un emploi judicieux des liquides, vasopresseurs et agents inotropes est nécessaire. Des pressions de remplissage élevées sont requises pour remplir le ventricule gauche non compliant. On doit traiter agressivement l’hypotension car la réanimation cardiopulmonaire a peu de chance de réussir en présence d’une valve aortique sténosée.
En général, la technique anesthésique a peu de chances d’avoir une incidence significative sur les résultats. L’anesthésie locale et la sédation fonctionnent bien pour l’approche trans-fémorale. La douleur est minimale sauf lorsque les structures vasculaires sont distendues. Les patients sous approche trans-fémorale peuvent recevoir du fentanyl avec des petites doses de midazolam au besoin avec une anesthésie locale du site par infiltration. Des techniques d’anesthésie intraveineuse à objectif de concentration avec propofol ou remifentanil ont été décrites et sont des options appropriées14. Les avantages d’une sédation minimale incluent la possibilité d’évaluer rapidement toute complication neurologique, l’absence de complications respiratoires et la récupération rapide avec un congé précoce20.
L’emploi de techniques régionales vise à réduire l’utilisation des opiacés et à éviter la sédation excessive et l’altération des fonctions cognitives. Pour l’approche trans-apicale, l’emploi d’un bloc en continu des nerfs intercostaux, du bloc para-vertébral thoracique et de l’épidurale thoracique ont été décrits4. Dans l’approche trans-fémorale, l’infiltration du site avec anesthésiques locaux et l’épidurale lombaire ont été décrites mais cette dernière requiert la prudence vu la nécessité d’hépariniser le patient avec cible d’ACT à 250 secondes. La possibilité d’avoir recours à une circulation extracorporelle d’urgence doit aussi être considérée19.
Par ailleurs, l’anesthésie générale permet un meilleur contrôle des complications et est avantageuse chez les patients qui ne peuvent rester immobiles sur le dos pour de longues périodes. Elle permet aussi l’utilisation de l’échographie trans-oesophagienne qui est supérieure à l’échographie trans-thoracique intermittente pour faciliter la livraison et le déploiement de la valve. De ce fait, on pourrait réduire l’incidence de malposition et de fuite paravalvulaire4, 21. La fuite paravalvulaire dépend de plusieurs facteurs qui incluent le type de valve employé, les irrégularités des calcifications de l’anneau valvulaire, et le choix d’une valve trop petite. L’incidence de ces complications pourrait diminuer avec les améliorations apportées aux valves de seconde génération6.
Le choix des agents pour l’induction et le mainten dépend de l’approche procédurale et de l’anesthésiologiste. Les besoins en anesthésie pour l’IVAP sont moindres en raison de la nature minimalement invasive de l’intervention, l’âge avancé du patient, les atteintes rénales et la fonction cardiaque altérée. Les besoins en analgésie sont minimes pour l’approche trans-fémorale et modérés pour la trans-aortique et trans-apicale. Au final, les hautes doses d’opiacées utilisées pour le RCVA ne sont jamais nécessaires4. Pour la phase de maintien, les agents d’inhalation le TIVA sont employés et vont donner une récupération rapide.
Le recouvrement va habituellement se faire en unité de soins coronariens, mais un séjour en unité de soins critiques pourrait être indiqué dans les cas d’approche trans-apicale et trans-aortique. Avec l’aide d’inotropes ou de vasopresseurs, on doit s’assurer du maintien d’une fonction cardiaque adéquate et d’une bonne perfusion des organes. L’extubation précoce est aussi visée. En comparaison avec le RCVA, on s’attend à ce que la phase de recouvrement soit plus courte avec un séjour plus court en unité de soins critiques et un congé de l’hôpital plus précoce.
STADES DE LA PROCEDURE
On dénombre 4 stades, chacun présentant des problèmes spécifiques.
1. Pré déploiement
L’accès est assuré via l’artère fémorale et l’artère radiale droite avec un cathéter-guide (pigtail). Un stimulateur cardiaque trans-veineux est inséré dans la veine fémorale. A cette étape, les problèmes sérieux arrivent habituellement au site fémoral artériel par où la valve sera insérée. Une hémorragie, une dissection ou une rupture vasculaire peuvent survenir 4, 16,19.
2. Valvuloplastie par ballonnet
Cette étape peut être nécessaire pour certaines valves et non pour d’autres. Tout dépend si une VAB a été faite dans les 4 à 6 semaines précédentes, lors de la phase de préparation du patient. La valve aortique devrait être dilatée pour assurer un bon positionnement de la prothèse dans la racine de l’aorte ascendante. La valvuloplastie permet un meilleur passage de la prothèse. Elle est faite sous une stimulation ventriculaire rapide à un rythme de 180 à 220 battements par minute19 d’une durée maximale de 5 à 10 secondes pour éviter de provoquer subséquemment de l’ischémie ou des arythmies. Avec la valve “LOTUS”, la stimulation cardiaque rapide après le positionnement initial n’est pas nécessaire. Cette valve prend 5 minutes à se déployer et peut être replacée une deuxième fois si la position initiale n’était pas satisfaisante. La valve Edwards nécessite la stimulation rapide, mais procédure complète de positionnement de fait en 6 à 8 secondes. A ce moment, la pratique acceptée est d’administrer un petit bolus de vasopresseur entre les séquences de stimulation cardiaque rapide pour maintenir la pression systolique au-dessus de 75 mm Hg. Une infusion de vasopresseurs ou d’inotropes peut aussi être utilisée4, 16,19.
3. Positionnement et déploiement
On doit employer la stimulation ventriculaire rapide avec les dispositifs nécessitant une dilatation par ballonnet pour diminuer le débit cardiaque, pour assurer une stabilité lors du positionnement et pour prévenir les atteintes myocardiques. Les dispositifs à auto-déploiement ne nécessitent pas de stimulation cardiaque rapide. Durant le positionnement, les gros cathéters utilisés peuvent perturber l’apport sanguin dans les vaisseaux perfusant le cerveau – un déploiement rapide doit être effectué dans cette éventualité4, 6,19.
Problèmes possibles durant cette étape16, 19:
- Embolisation du dispositif dans l’aorte ou le ventricule gauche
- Régurgitation para-valvulaire
- Positionnement incorrect
- Obstruction des ostia coronaires
- Arythmie
- Asystolie du ventricule gauche ou dissociation électro-mécanique, surtout avec mauvaise fonction ventriculaire
- Bloc Auriculo-ventriculaire
- Entrave d’un feuillet de la valve mitrale
L’échographie, trans-oesophagienne sous anesthésie générale et trans-thoracique chez le patient éveillé donne de précieuses informations sur la fonction ventriculaire, la nécessité de dilater encore plus, la bonne position de la valve et sur la présence d’une fuite para-valvulaire.
4. Post-déploiement
C’est l’angiographie va permettre d’évaluer la position de la valve, la fonction ventriculaire et l’état des vaisseaux. Par la suite, le dispositif de livraison est retiré les vaisseaux sont réparés. Avec la diminution de la post-charge du ventricule gauche et l’augmentation du débit cardiaque, l’arrêt des vasopresseurs peut devenir nécessaire et l’emploi d’antihypertenseurs ou même l’infusion de GTN pourraient être requis pour contrôler l’hypertension qui peut survenir16, 19.
Afin de garantir stabilité et bonne fonction, un stimulateur cardiaque temporaire peut être nécessaire avec certains dispositifs et 3 à 7% des patients auront besoin d’un stimulateur permanent2, 4. Tous les sites d’accès doivent être surveillés en cas de saignement. Les pertes sanguines, surtout rétro-péritonéales, peuvent être difficiles à évaluer. Un environnement de soins critiques est plus propice à la détection de complications comme un hémothorax ou une tamponnade que l’on doit pouvoir reconnaitre précocément.
Un mauvais résultat post IVAP est attribuable à une comorbidité ou à la procédure elle-même2, 4,6. Une régurgitation aortique peut provenir d’une fuite para-valvulaire elle-même causée par une calcification irrégulière de l’annulus. Les complications vasculaires peuvent exiger une correction chirurgicale immédiate avec sternotomie et circulation extracorporelle, mais elles ont un très haut taux de mortalité.
C’est dans les systèmes cardiaque, neurologique et rénal qu’on retrouve surtout les complications. Comme la maladie coronarienne non revascularisée est fréquemment associée, une revascularisation percutanée est souvent indiquée avant l’IVAP. Tel que décrit ci-haut, une obstruction coronarienne peut survenir à cause d’un dispositif mal placé ou d’un feuillet cardiaque obstruant des coronaires ayant une origine basse dans le sinus de Valsalva.
L’accident vasculaire cérébral (AVC) est une complication connue. Le registre européen des résultats multirégionaux pour la bioprothèse aortique SAPIEN a montré un taux d’AVC 2.4%22. Ce risque est en baisse, possiblement en raison de l’utilisation de cathéters plus petits qui causent moins de trauma ou d’obstruction des vaisseaux originant de l’arche aortique. Le placement de filtres emboliques dans le tronc brachio-céphalique et la carotide gauche a mené à une réduction des lésions cérébrales6.
Des données sur la fonction rénale dans le registre des résultats suggèrent une hausse de la créatinine post-IVAP dans 5 à 28% des cas23. Ceci s’améliore habituellement en raison de la hausse du débit cardiaque, mais les facteurs associé à la détérioration incluent l’utilisation de substances de contraste, l’hypo-perfusion et les transfusions sanguines2.
Le suivi clinique et échographique des valves sur 5 ans est bien documenté. Une défaillance tardive des feuillets est rare. Seul le temps dira si leur durabilité est comparable celle des valves chirurgicales24. Cela est très important si l’IVAP doit être offerte à des groupes de patients plus jeunes dans le futur12, 25. Il existe des informations à l’effet qu’une ré-intervention chez ces patients 10 ans plus tard pourrait ne pas être si simple. L’accès au site resterait facile mais par la suite, le degré de fibrose autour de l’implant pourrait commander une chirurgie majeure tel un remplacement de l’arche aortique.
CONCLUSION
L’implantation percutanée d’une valve aortique est maintenant une technique bien établie pour le traitement de la sténose aortique chez le patient à haut risque. L’expertise pour l’IVAP progresse rapidement et la technologie des valves implantables est en évolution6. La population cible présente des défis importants et continuera de profiter d’une approche multidisciplinaire durant la période péri-opératoire.
Une bonne connaissance des indications de la procédure est pertinente pour les anesthésiologistes impliqués dans les cliniques péri-opératoires. Comme certains patients porteurs d’une sténose aortique sévère peuvent se présenter pour une chirurgie non-cardiaque en dehors des centres tertiaires, ceux-ci peuvent être référés pour évaluation dans les hôpitaux appropriés.
Les considérations anesthésiques pour une procédure comme l’IVAP sont applicables à un certain nombre de situations rencontrées dans des salles hybrides et des salles de radiologie. Il y a des similarités conceptuelles entre, par exemple, les procédures neuroradiologiques, thoraciques et endovasculaires. Comme les indications vont se multiplier, il est probable que la demande pour des soins anesthésiques sécuritaires augmente dans ces contextes.
ANSWERS TO QUESTIONS
- En ce qui concerne la sténose aortique:
- Vrai
- Faux: Elle est présente chez 25% des adultes de plus 65 ans.
- Vrai
- Vrai
- Vrai
- Concernant le traitement de la sténose aortique:
- Vrai: Les nitrates vont réduire la résistance vasculaire périphérique et diminuer la perfusion coronarienne
- Vrai: Les 2 agents peuvent être utilises, mais pas ensemble.
- Vrai
- Faux: Les deux agents aident à améliorer les symptômes de la sténose aortique. La digitale améliore la contractilité; les diurétiques réduisent l’oedème pulmonaire.
- Vrai: Les I-ECA peuvent être utilisés avec prudence.
- Concernant la gestion péri-opératoire de l’IVAP:
- Vrai: L’instabilité hémodynamique peut être détectée et traitée promptement.
- Faux: Les rythmes autres que sinusaux diminuent le débit cardiaque. Les contractions auriculaires synchrones contribuent jusqu’à 40% de la pré-charge.
- Vrai: Des pressions de remplissage élevées sont requises pour remplir le ventricule non-compliant.
- Vrai: Une diminution de la résistance vasculaire systémique diminue la perfusion coronarienne.
- Faux: La réanimation cardiopulmonaire a peu de chance d’être efficace sur une valve sténosée.
RÉFÉRENCES ET LECTURES SUPPLÉMENTAIRES
- Chambers, J.B. (2009) ‘Aortic stenosis’, European Journal of Echocardiography, 10(1), pp. i11–i19 doi: 10.1093/ejechocard/jen240.
- Chacko, Matthew, and Laurence Weinberg. “Aortic Valve Stenosis: Perioperative Anaesthetic Implications of Surgical Replacement and Minimally Invasive Interventions.” Continuing Education in Anaesthesia, Critical Care & Pain 12.6 (2012): 295–301.
- Wikipedia. [Place unknown]: Wikimedia Foundation; 2016 Jul 5. Aortic stenosis; Available from: https://en.wikipedia.org/wiki/Aortic_stenosis. (Accessed 10 July 2016)
- Klein, A. A., et al. “Transcatheter Aortic Valve Insertion: Anaesthetic Implications of Emerging New Technology.” British Journal of Anaesthesia (2009) 103.6: 792–799.
- Lung, B. “A Prospective Survey of Patients with Valvular Heart Disease in Europe: The Euro Heart Survey on Valvular Heart Disease.” European Heart Journal (2003) 24.13: 1231–1243.
- Bourantas, C. V., and P. W. Serruys. “Evolution of Transcatheter Aortic Valve Replacement.” Circulation Research (2014) 114.6: 1037–1051.
- Thourani VH, Ailawadi G, Szeto WY, Dewey TM, Guyton RA, Mack MJ, Kron IL, Kilgo P, Bavaria JE. Outcomes of surgical Aortic valve replacement in high-risk patients: A Multiinstitutional study. The Annals of Thoracic Surgery. (2011) Jan; 91(1): 49–56.
- Leon, Martin B., et al. “Transcatheter Aortic-Valve Implantation for Aortic Stenosis in Patients Who Cannot Undergo Surgery.” New England Journal of Medicine (2010) 363.17: 1597–1607.
- Grubb KJ, Fields T, Cheng A, Settles DM, Stoddard M, Flaherty MP. Transaxillary Transcatheter Aortic Valve Replacement with a Self-Expanding Valve under Conscious Sedation: Case Discussion and Review of the Literature. Clin Surg. 2016; 1:1019. http://www.clinicsinsurgery.com/pdfs_folder/cis-v1-id1019.pdf
- Smith, Craig R., et al. “Transcatheter Versus Surgical Aortic-Valve Replacement in High-Risk Patients.” New England Journal of Medicine (2011) 364.23: 2187–2198.
- TAVI: A Solution for All Patients: A Pro-Con Debate at ESC 2015. Medscape. Aug 30, 2015.http://www.medscape.com/viewarticle/850256 (Accessed 10 July 2016)
- Vahanian, A., et al. “Guidelines on the Management of Valvular Heart Disease (version 2012): The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS).” European Heart Journal 33.19 (2012): 2451–2496.
- Khawaja, M.Z., Williams, R., Hung, J., Arri, S., Asrress, K.N., Bolter, K., Wilson, K., Young, C.P., Bapat, V., Hancock, J., Thomas, M. and Redwood, S. ‘Impact of preprocedural mitral regurgitation upon mortality after transcatheter aortic valve implantation (TAVI) for severe aortic stenosis’, Heart, (2014) 100(22), pp. 1799–1803.
- Rau, S., Wessely, M., Lange, P., Kupatt, C., Steinbeck, G., Fischereder, M. and Schönermarck, U. ‘Transcatheter Aortic valve implantation in dialysis patients’, Nephron Clinical Practice, (2012) 120(2), pp. c86–c90.
- Jobeir, Med Asaad. Anesthesia for Transcatheter Aortic Valve Implantation. http://www.sha-education.com/sites/all/sha23_presentations/30-1-2012/066002.pdf. (Accessed 10 July 2016)
- Bleiziffer, S., et al. “Which Way in? The Necessity of Multiple Approaches to Transcatheter Valve Therapy”. Current Cardiology Reviews 9.4 (2014): 268–273.
- Petronio A, Carlo M, Giannini C, Carlo F, Bortolotti U. Digital, E and publishing (2013) Subclavian TAVI: More than an alternative access route. Available at: https://www.pcronline.com/eurointervention/S_issue/volume-9/supplement-s/7/subclavian-tavi-more-than-an-alternative-access-route.html (Accessed: 31 December 2016)
- Zhu, Haibei, et al. “Direct Aortic Transcatheter Aortic Valve Implantation: Anaesthesia Attentions.” Proceedings of Singapore Healthcare 24.1 (2015): 59–64. http://psh.sagepub.com/content/24/1/59.full.pdf+html (Accessed 10 July 2016)
- Wiegerinck, E. M. A., et al. “Towards Minimally Invasiveness: Transcatheter Aortic Valve Implantation Under Local Analgesia Exclusively.” International Journal of Cardiology (2014) 176.3: 1050–1052.
- Developed by the American Society of Anesthesiologists Task Force on Perioperative Transesophageal Echocardiography, et al. “Practice Guidelines for Perioperative Transesophageal Echocardiography.” The Journal of the American Society of Anesthesiologists (2010) 112.5: 1084–1096.
- Schymik, Gerhard, et al. “European Experience with the Second-Generation Edwards SAPIEN XT Transcatheter Heart Valve in Patients with Severe Aortic Stenosis.” JACC: Cardiovascular Interventions (2015) 8.5: 657–669
- Bagur, R., et al. “Acute Kidney Injury Following Transcatheter Aortic Valve Implantation: Predictive Factors, Prognostic Value, and Comparison with Surgical Aortic Valve Replacement.” European Heart Journal (2009) 31.7: 865–874.
- Early Transcatheter Aortic-Valve Device Durability Comes Under Scrutiny. Medscape. May 31, 2016. http://www.medscape.com/viewarticle/864039 (Accessed 10 July 2016)
- Sapien 3 TAVR Superior to Surgery in Intermediate-Risk Aortic-Stenosis Patients, Says Study. Medscape. Apr 05, 2016. http://www.medscape.com/viewarticle/861469 (Accessed 10 July 2016)
Figure 1 and 3 reproduced with permission from Edwards Life sciences http://www.edwards.com/eu/Products/TranscatheterValves/Pages/sapien3.aspx?WT.ac=S3campaignprod.



