Obstetric Anaesthesia
PUNTOS CLAVE
- Las complicaciones principales después de bloqueo neuroaxial obstétrico ( vs no obstétrico) ocurren con poca frecuencia por el estado de salud de la paciente y la corta duración de la cateterización epidural.
- La cefalea postparto ocurre en 39% de los pacientes dentro de la primera semana; sin embargo 5% se deben a cefalea postpunción de duramadre .
- El tratamiento conservador de la cefalea postpunción de duramadre no esta bien demostrada; el tratamiento definitivo involucra administración de parche sanguíneo epidural.
- La mayoría de neuropatías postparto se deben a causas no anestésicas( ej., relacionadas con obstetricia).
- Los déficit neurológicos después de bloqueo neuroaxial siempre deben ser adecuadamente investigados
- La administración intravenosa de emulsión lipídica al 20 % ha avanzado significativamente el tratamiento dela toxicidad sistémica por anestésico local.
INTRODUCCION
Las principales complicaciones después de anestesia neuroaxial ocurren menos frecuentemente en pacientes obstétricas que en pacientes No-obstétricas , lo cual esta relacionado el adecuado estado de salud de la paciente obstétrica y a la menor duración de la cateterización epidural.1 Las complicaciones relacionadas al bloqueo neuroaxial están en la Tabla .
COMPLICACIONES NEUROLOGICAS
El tercer Proyecto de Auditoria Nacional ( NAP 3) publicado por El Colegio Real de Anestesiólogos de Reino Unido, investigó la incidencia de daño permanente al paciente como resultado de bloqueo neuroaxial central y reportó 12 casos relacionados a anestesia obstétrica.1 Cinco de estos casos se recuperaron rápida y totalmente, mientras 7 casos tuvieron una complicación con potencial inhabilidad. La mas alta incidencia de daño permanente fue reportada en pacientes adulto ( no obstétrico).
CEFALEA POST PUNCION DURAMADRE
Incidencia
La punción de duramadre puede ser intencional con una aguja espinal ( o técnica epidural-espinal combinada CSE) o no intencional con aguja Touhy ( epidural o técnica TEE) , que puede producir cefalea post punción de duramadre ( PDPH). La incidencia de PDPH usando aguja espinal Quincke con aguja 27 a 30 ( bisel cortante) es del 3.5%, y la incidencia con aguja 24 a 26 espinal punta de lápiz es del 0.8%.2 El riesgo de punción dural no intencional con aguja Toughy 16 es de 0.91% de los cuales el 88% tendrán cefalea postpunción (2). La incidencia de PDPH después de punción dural no intencional con aguja Toughy 18 es del 64%. EL Colegio Real de Anestesiólogos sugiere una aceptable rata de punción dural no intencional menor del 1% .
Fisiopatología y Diagnóstico
La fuga de liquido espinal cerebral (LCR) por una punción dural causa disminución de presión intracraneana; el mecanismo por el cual esto causa cefalea no es claro. Puede ser por tracción de estructuras craneales sensibles al dolor o por depleción de volumen de LCR, que induce vasodilatación cerebral compensatoria ( the Monro-Kellie doctrine) , y activación de receptores de adenosina que pueden causar vasodilatación cerebral. Los factores de riesgo a desarrollar PDPH son edad joven, genero femenino, embarazo, historia positiva previa, parto vaginal, y operador con poca experiencia.
Los criterios diagnósticos para PDPH definidos por la Sociedad de Cefalea Internacional (www.ichd3.org) incluyen lo siguiente:
- Cefalea que cumpla los criterios de cefalea atribuida a baja presión de LCR y criterio ‘c’ de esta lista
- ocurrencia de punción dural
- cefalea desarrollada dentro de los cinco días de punción dural.
- no estar en otra Clasificación de Cefalea Internacional
Diagnostico Diferencial
Dentro de la primera semana postparto , hasta el 39% de los pacientes tiene síntomas de cefalea, con o sin bloqueo neuroaxial . Los cambios hormonales, estado de ayuno/ deshidratación, cansancio, retiro de cafeína, pueden causar cefalea. Mas del 75% de la cefalea postparto tiene una causa primaria como la migraña tensional, cervicogénica, y por brotes . la cefalea secundaria en el periodo postparto se debe a complicaciones de anestesia neuroaxial, ( ej.: PDPH) , enfermedad obstétrica( ej.: desordenes hipertensivos) , o patología intracraneal( ej.: trombosis venosa cerebral) . LA PDPH es el 4.7 % de todos las cefaleas post parto , la mayoría de severidad moderada.
Tratamiento
Lo mas recomendado para PDPH es el reposo en cama y la hidratación, pero su eficacia no está bien probada. El tratamiento sintomático para PDPH con analgésicos (acetaminofén, antiinflamatorios no esteroideos, antieméticos, y bloqueo tópico de ganglio esfenopalatino (GEP) pueden controlar lo síntomas y reducir la necesidad de tratamiento ,as agresivo; sin embargo , no tiene efecto en la fuga de LCR por la ventana dural. El bloqueo de GEP interviene en la vasodilatación intracraneal vía ganglio parasimpático del nervio VII . Hasta ahora, solo estudios retrospectivos y serie de casos se han publicado, requiriéndose grandes estudios prospectivos que evalúen si este bloqueo puede reemplazar el parche epidural de sangre (PES). Algunos recomiendan el uso de cafeína intravenosa 500 mg para el tratamiento sintomático de PDPH; sin embargo la evidencia no es convincente. La cafeína tiene un efecto vasoconstrictor y reduce el flujo sanguíneo cerebral.3
El tratamiento definitivo de PDPH es el PES, inyección de sangre antóloga en el espacio epidural, idealmente en el mismo o un nivel vertebral menor que el nivel inicial de la punción dural (por un anestesiólogo experimentado) El postulado es que ésto reduce los síntomas por un incremento en la presión del canal lumbar neuroaxial, lo cual comprime el saco tecal. Esta presión aumentada transloca el LCR del canal espinal al craneo3 y el beneficio terapéutico se atribuye a la formación de un coagulo sobre el sitio de punción , previniendo mayor fuga de LCR. El volumen optimo de sangre no ha sido determinado todavía,; sin embargo, es recomendado inyectar 20 ml de sangre. Si el paciente experimenta resolución de síntomas , o desarrolla dolor lumbar o de muslos, la inyección debe pararse antes de alcanzarse el limite de 20 ml.
Implicaciones Anestésicas
Para anestesia espinal, el uso de aguja punta de lápiz ( a diferencia de la aguja cortante) es recomendada por si menor incidencia de PDPH.
Para anestesia epidural ( o TEE), si ocurre punción dural no intencional con la aguja Toughy, se recomienda lo siguiente:
- Si la localización del espacio epidural ha sido problemática, se debe considerar introducir el catéter intratecalmente a través de la aguja Toughy.
- Si la colocación del catéter epidural no ha sido problemático, considere colocar el catéter epidural intartecalmente3
Se debe tener es consideración varios aspectos par determinar cual técnica es la mas apropiada y segura después de punción dural no intencional.
Ventajas de colocar el catéter intratecalmente :
- La colocación intratecal del catéter evita la necesidad de reubicación y una segunda punción dural u otra complicación relacionada con su colocación
- Rápido inicio de analgesia
Desventajas de colocar el catéter intratecalmente:
- El catéter intratecal puede ser confundido con un catéter epidural y usado con dosis / bolos inapropiadamente
- Se aumenta la posibilidad de meningitis porque catéter queda cerca del sistema nervioso central
- Hay posibilidad de desconexión accidental del catéter con pérdida de LCR
- Hay mayor incidencia de migración del catéter y falla en las ultimas etapas del parto
Desafíos comunes
La hipotensión craneal y fuga crónica de LCR pueden traccionar venas puentes que pueden romper y producir hematoma subdural o subaracnoideo agudo o crónico. La fuga crónica puede causar parálisis de nervios craneales, debido a aporte sanguíneo alterado , siendo el nervio craneal mas afectado el VI , por su mayor recorrido intracraneal.
DAÑO NERVIOSO
Incidencia
La incidencia de daño nervioso permanente después de bloqueo neuroaxial es entre 1:80 000 y 1:320 425. 1
Las etiologías relacionadas con obstetricia ( no anestésicas ) son las mayoría de las neuropatías postparto.
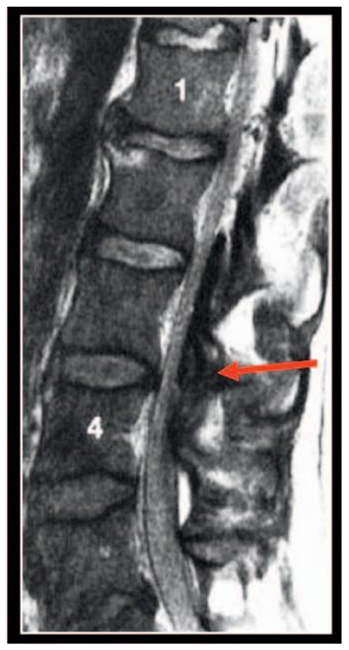
Figura 1. Hematoma del canal vertebral. La flecha señala el hematoma (1)
Fisiopatología y Diagnóstico
El trauma directo al tejido nervioso por una aguja espinal o epidural puede ocurrir al nivel de la medula espinal o raíz nerviosa. La mayoría de casos son asociados con parestesia en la inserción de la aguja. El dolor , parestesia, y debilidad muscular en la distribución del nervio puede no ser clínicamente evidente hasta que el bloqueo ha cedido. Los síntomas agudos no necesariamente están asociados a la técnica neuroaxial, pero pueden ser la presentación inicial de una enfermedad neurológica , que requiere mayor investigación.
Tratamiento
La mayoría de pacientes que experimentan lesión nerviosa traumática se recuperan totalmente; sin embargo todos deber ser seguidos clinicamente.
Desafíos comunes
El cono se extiende debajo de L1-2 en aproximadamente 20% de los pacientes ; por lo tanto, la anestesia espinal siempre debe ser colocada debajo del nivel de L3. El ultrasonido puede ser para la colocación de la punción neuroaxial en el nivel apropiado. Esto facilita la colocación de bloqueo neuroaxial en casos difíciles para reducir tiempo y número de intentos.7 No hay datos que sugieran que el ultrasonido disminuya la incidencia de complicaciones.
HEMATOMA CANAL VERTEBRAL
Los hematomas epidurales y espinales son complicaciones raras pero potencialmente catastróficos del bloqueo neuroaxial. La incidencia reportada es de 1: 150 000 para hematoma epidural y 1: 220 000 para espinal.8 Los factores de riesgos asociados con estas complicaciones incluyen genero femenino, edad avanzada, colocación traumática de la aguja/catéter, y colocación o retirada de catéter en pacientes anticoagulados.8
El hematoma agudo en canal vertebral usualmente de presenta con dolor lumbar de inicio súbito, a menudo radicular con déficit motor y sensitivo debajo del nivel de la compresión de médula espinal.
Cuando una infusión epidural es descontinuada por razones clínicas , la recuperación debe ocurrir dentro de 4 horas y continuar progresando. 1 Si esto no ocurre , se debe realizar una resonancia magnética nuclear ( RMN) ( figura 1 ).1. La descompresión quirúrgica dentro delas 8 a 12 horas de inicio de lo síntomas puede resultar en buena recuperación neurológica .9
Si se sospecha un hematoma en canal vertebral, se debe aclarar el diagnostico antes de retirar el catéter . La observación neurológica debe continuar por 24 horas después de la retirada del catéter epidural y mas si el paciente continua inmóvil.1
Recomendaciones
La mayoría de clínicos están tranquilos cuando se realiza bloqueo neuroaxial cuando las plaquetas son mayores de 80.000. Cuando se mide la relación riesgo vs beneficio, en el rango de plaquetas entre 70-80.000 el bloqueo es seguro; en el rango de 50-70.000 se debe realizar mas evaluaciones individuales del paciente que lo justifique , y en conteos menores de 50.0000, usualmente pero no siempre, es mejor evitar el bloqueo neuroaxial. 10 Es importante la valoración de la cantidad de plaquetas y su calidad( función plaquetaria) y su velocidad de disminución ( ej. en trombocitopenia gestacional, idiopática, en purpura trombocÍtica, preeclampsia , y sepsis ).
Es importante tomar en consideración la historia del paciente y el examen físico para identificar signos y síntomas de trombocitopenia. En el paciente obeso con estomago lleno , con vía aérea difícil anticipada, o pacientes con preeclampsia, un valor bajo de plaquetas podría ser mas aceptable, cuando se mira el riesgo de anestesia general vs anestesia regional. El uso de anestésico local en baja concentración para analgesia de trabajo de parto puede ayudar a pacientes que están con alto riesgo de hematoma , porque si desarrollan un bloqueo motor denso, los estudios pueden ser realizados tempranamente.
ABSCESO EPIDURAL
La incidencia de absceso epidural es de 1:62 866 en la población obstétrica. 11 La formación de absceso epidural resulta de bacterias hematógenas sembradas en el espacio epidural o contaminación de la flora de piel 12 El agente mas frecuentemente encontrado es estafilococo (57%), seguido de estreptococo (18% ) y bacilo gram-negativo ( 13 %) 13 Los síntomas clínicos de un absceso epidural usualmente empiezan varios días después del bloqueo neuroaxial, pero su presentación puede retrasarse hasta varios meses. Los síntomas son dolor lumbar, , fiebre, malestar general, signos de compresión medular,( cambios sensitivos, parálisis fláccida seguida de parálisis espástica), leucocitosis, proteína y células blancas elevadas en LCR. 1 Hay alta variabilidad individual en la presentación y grado de deterioro neurológico, y la triada clásica( dolor lumbar, fiebre y déficit neurológico) no siempre esta presente. 1
El método mas sensible y especifico es la RMN con gadolinio.1 El tratamiento de un absceso epidural es antibiótico ( 4 – 6 semanas ) y posible drenaje quirurgico.12 Los antibióticos incluyen agentes contra Staphylococus aureus, incluyendo organismos meticilino-resistentes, y organismos gram-negativos anaerobios, especialmente en pacientes con historia de abuso de drogas endovenosas. El régimen sugerido es vancomicina , metronidazole, y cefotaxime.
MENINGITIS
La incidencia estimada de meningitis después de bloqueo neuroaxial es menos de 1: 200 000.1 La meningitis bacteriana puede ocurrir por el equipo contaminado o siembra hematógena después de un bloqueo neuroaxial. Después de anestesia epidural / espinal o punción dural diagnostica, los comensales nasofaríngeos (ej. Streptococcus) han sido identificados, sugiriendo diseminación por dotas de la vía aérea del anestesiólogo con transferencia directa hacia el LCR.1 Los síntomas de meningitis usualmente se desarrollan en 24 a 48 horas después del bloqueo neuroaxial, y el pronostico de meningitis bacteriana es generalmente bueno si el antibiótico apropiado se comienza tempranamente.
La anestesia espinal en pacientes con infección co-existente es controversial. En pacientes con evidencia de bacteriemia, es recomendado que los antibióticos sean suministrados ( con evidencia de respuesta) antes del boqueo neuroaxial.1
Recomendaciones
La Asociación de Anestesiólogos de Gran Bretaña e Irlanda recomiendan preparación de la piel con clorhexidina gluconato al 0.5% en alcohol al 70% ( con tiempo de secado adecuado) antes del todo bloqueo neuroaxial para reducir incidencia de complicaciones infecciosas ( Figura 2 ) 12 En Estados Unidos , se usa clorhexidina gluconato de 2 al 3 % en alcohol al 70% .Se debe hacer un adecuado lavado de manos y precauciones de estrilidad.12
ARACNOIDITIS
Hay una limitada evidencia de aracnoiditis después de anestesia neuroaxial. Hay escasos reportes de desarrollo de aracnoiditis después de inyección no -intencional de clorhexidina en el espacio epidural y/o espinal. Los pacientes suelen presentar dolor lumbar, disestesia y parestesia que no siguen la distribución de dermatoma habitual10.

Figura 2. Clorhexidina gluconato 0.5% en alcohol al 70% alcohol para preparación de piel (1).
SINDROME NEUROLÓGICO TRANSITORIO (SNT)
El SNT es un síndrome de dolor y disestesia en caderas, los muslos o las pantorrillas que puede ocurrir después de la anestesia espinal. Es auto limitado y generalmente se resuelve dentro de las 72 horas. La lidocaína se ha implicado en la mayoría de los casos, pero también se ha encontrado que la bupivacaína causa SNT leve con características clínicas sutiles. La SNT no suele asociarse con ninguna patología neurológica11.
RETENCIÓN URINARIA
La anestesia neuroaxial bloquea las raíces nerviosas S2-S4, disminuye el tono de la vejiga urinaria e inhibe el reflejo de evacuación; por lo tanto, los agentes anestésicos locales de acción prolongada requieren un tiempo más prolongado para que la función de la vejiga se recupere.14 Los opioides espinales también influyen en la función de la vejiga y causan retención urinaria14.
EVALUACIÓN DE DEFICITOS NEUROLÓGICOS
La mayoría de las neuropatías posparto se deben a causas no anestésicas (ej. relacionadas con la obstetricia). La historia, el examen neurológico, las investigaciones de diagnóstico y el manejo adecuado en un entorno multidisciplinario que involucre a un neurólogo deben minimizar el riesgo de lesión neurológica permanente. El empeoramiento de los síntomas o la presentación neurológica después de un período sin síntomas debe revisarse de inmediato. Un examen neurológico completo que incluya la evaluación de los nervios craneales y los signos de sepsis concurrente es esencial. El mapeo de los síntomas del paciente puede revelar un patrón consistente con una lesión nerviosa periférica.
Si se sospecha el diagnóstico de un absceso epidural, meningitis o hematoma espinal, se deben realizar exámenes de laboratorio de rutina, que incluyen hemograma completo, hemocultivos y pruebas de coagulación. Investigaciones más invasivas, como la punción lumbar, son beneficiosas cuando se sospecha meningitis. La RMN (con o sin gadolinio) puede revelar edema de la médula espinal y áreas de inflamación.1 Las investigaciones electrofisiológicas pueden diferenciar entre la lesión nerviosa central y periférica, identificar los músculos afectados, dar un pronóstico probable de recuperación neuronal y dar una estimación temporal de la lesión (que es de particular interés con respecto a los posibles litigios).
Es importante realizar una historia y un examen exhaustivos antes de la anestesia neuroaxial y documentar cualquier neuropatía preexistente para que cualquier síntoma y / o signos que se desarrollen después del procedimiento puedan diferenciarse entre agudo y crónico.
COMPLICACIONES CARDIOVASCULARES
La simpatectomía química del bloqueo neuroaxial puede ser exagerada por los cambios fisiológicos del embarazo, lo que lleva a una hipotensión en el 55% al 90% de los pacientes que reciben anestesia espinal para la cesárea.15 La disminución de precarga después de anestesia espinal puede iniciar reflejos (ej. reflejo Behold-Jarish, reflejo de estiramiento y barorreceptores de baja presión) que causan bradicardia severa.
El bolo cristaloide rápido IV al mismo tiempo de la administración de la anestesia espinal (carga conjunta) es más eficaz para mantener la presión arterial materna en comparación con la precarga.16 La administración de vasopresores también puede bloquear la respuesta hipotensiva. La evidencia actual confirma a la fenilefrina sobre la efedrina como vasopresor de primera línea, administrada por bolo o infusión (50 lg / min o 0,5 lg / kg / min), aunque se ha demostrado que la infusión profiláctica de fenilefrina es más efectivo.17,18 Un enfoque actual de la investigación es la acción de otros agentes, con especial interés en la noradrenalina como una alternativa eficaz a la fenilefrina, que tiene la ventaja de mantener una frecuencia cardíaca y un gasto cardíaco estables.17
TOXICIDAD SISTÉMICA POR ANESTÉSICO LOCAL (TSAL)
Las altas concentraciones plasmáticas de anestésicos locales pueden causar toxicidad en el sistema nervioso central (SNC) y cardiovascular. Los estudios han reportado una incidencia de TSAL de 1,2 a 11 por 10 000 anestesia epidural.19 El estudio NAP 3 identificó 11 casos de administración de anestésicos locales por vía errónea en el Reino Unido durante un período de 1 año, y 6 fueron inyecciones de bupivacaína por vía intravenosa 1. TSAL puede ocurrir debido a la inyección intravenosa accidental o la absorción sistémica del espacio epidural. La incidencia de toxicidad se puede reducir administrando una dosis de prueba (con o sin adrenalina) para excluir la colocación intravascular, aspirando el catéter epidural antes de inyectar, administrando anestésicos locales con perfiles de baja toxicidad, usando regímenes de dosificación incrementales y usando una punta suave catéter epidural. El uso de una dosis de prueba que contenga adrenalina para excluir la colocación intravascular durante el parto es discutible, ya que los pacientes mostrarán taquicardia debido a las contracciones y el dolor. Aspirar el catéter epidural para identificar sangre / LCR puede dar resultados falsos negativos, por lo que cada vez que un catéter es usado (y durante toda la duración de la infusión epidural), se debe observar a los pacientes para detectar signos de síntomas y signos de administración intravascular / intratecal de anestesia local.
Las características de TSAL en el sistema nervioso central incluyen parestesia perioral, inquietud que puede progresar a convulsiones, insuficiencia respiratoria e inconsciencia. La toxicidad cardiovascular generalmente comienza después de los signos de toxicidad del SNC y puede presentarse con bradicardia extrema o arritmia ventricular (maligna) que puede conducir a un paro cardíaco refractario. La administración de 20% de la solución de emulsión lipídica IV ha avanzado significativamente el manejo de TSAL.19
EFECTOS SECUNDARIOS RELACIONADOS CON LOS FARMACOS
Náuseas y vómitos
La incidencia de náuseas y vómitos durante la cesárea puede ser tan alta como 80% dependiendo de la técnica anestésica utilizada (espinal, epidural o TEE ) y si se toman medidas preventivas o terapéuticas.20 La etiología es multifactorial e incluye reducción inducida por progesterona en el tono del esfínter esofágico inferior, aumento de la presión intragástrica, hipotensión, exteriorización del útero, estimulación visceral y uso de opioides neuroaxiales. La incidencia es mayor con los opioides hidrofílicos, como la morfina, y puede reducirse al 7% con fentanyl 20. Las medidas preventivas incluyen el desplazamiento del útero a la izquierda, la precarga de líquidos por vía intravenosa, el uso de vasopresores, la dosis óptima de opioides neuroaxiales, evitar los opioides parentales, administración lenta de medicamentos uterotónicos, administración de vagolíticos y antieméticos, evitar la estimulación quirúrgica excesiva y minimizar los movimientos.20 Las medidas terapéuticas incluyen la administración de medicamentos antieméticos.
Depresión respiratoria
Los estudios no obstétricos reportan una incidencia de depresión respiratoria después de la administración de opioides neuroaxiales de 0.01% a 7% .21 En la población obstétrica, aunque los opioides neuroaxiales se asocian con un riesgo muy bajo de depresión respiratoria clínicamente significativa, ocurre y puede tener consecuencias fatales .1,21
La depresión respiratoria después de la administración de la morfina neuroaxial es bifásica: puede ser temprana, ocurre dentro de los 30 a 90 minutos de la administración, muy probablemente debido a la absorción sistémica, o tardía, dentro de las 6 a 18 horas debido a la diseminación rostral (dadas las características hidrofílicas de la morfina) en la LCR al tronco cerebral. La diamorfina intratecal (300-400 lg) se recomienda para la analgesia postoperatoria después de la cesárea con preferencia a la morfina, ya que es más lipófila; sin embargo, la diamorfina no está disponible en América del Norte.
PRURITO
La incidencia y la gravedad del prurito dependen de la dosis de opioide y se presenta con mayor frecuencia después de la administración intratecal en comparación con la administración epidural (58% frente a 30%) 22. La causa no se conoce bien, pero es probable que no esté relacionada con liberación de histamina. Cada vez hay más pruebas de que el prurito inducido por opioides neuroaxiales está mediado a través de los receptores centrales de opioides. Los antagonistas opioides (ej. naloxona) o antagonistas agonistas parciales (ej. nalbufina) son eficaces para aliviar el prurito y la naloxona IV se puede administrar en dosis graduadas a partir de 40 lg.
ANAFILAXIA
Los opioides como la petidine (conocido como meperidina en Estados Unidos ), la codeína y la morfina son potentes desencadenantes de la liberación de histamina, y la mayoría de las reacciones son leves y no alérgicas, y se presentan solo con prurito y urticaria. La reacción mediada por Inmunoglobulina E (IgE) es muy rara. La adición de opioides a las soluciones de anestesia espinal mejora la densidad de bloqueo y proporciona analgesia postoperatoria. Sin embargo, los pacientes con una alergia significativa a los opioides deben evitar estos agentes.
Los pacientes informan frecuentemente sobre la alergia al anestésico local, pero la incidencia real de la reacción alérgica mediada por IgE es inferior al 1% .23 Los anestésicos locales basados en ésteres son más propensos que las amidas a provocar una reacción alérgica de tipo 4. El manejo de un paciente con antecedentes de alergia a los anestésicos locales plantea un desafío importante para el anestesista obstétrico. Las pruebas cutáneas pueden inducir anafilaxis, aunque tal reacción a los anestésicos locales es muy rara. El manejo de casos tan complicados y difíciles se debe realizar en estrecha colaboración con los especialistas en alergias y los equipos de atención obstétrica y anestésica.23 Las pruebas de alergia se deben realizar antes del embarazo o después del parto, pero si se considera necesario realizarlas durante el embarazo ( en muy raras circunstancias), debe realizarse cuando el feto es viable, en caso de parto de emergencia.
MISCELANEOS
Anestesia espinal Alta (total)
El bloqueo espinal completo es causado por la anestesia local que interfiere con la función neuronal normal en la médula espinal cervical y el tronco cerebral. Para minimizar el riesgo de espina alta o total, se deben considerar ciertos factores, que incluyen factores farmacológicos (ej. dosis, baricidad o administración epidural previa [consulte la sección Desafíos comunes]), factores del paciente (ej. morfología corporal, anomalía anatómica ) y factores técnicos (ej. el sitio de inserción, la posición posterior al bloqueo , el calibre de la aguja y la dirección durante la inyección) .24
Las manifestaciones clínicas varían con la altura del bloqueo e incluyen disnea secundaria a parálisis del músculo intercostal (T1-T12), bradicardia e hipotensión (T1-T4), parestesia en las manos (T1), paro respiratorio secundario a parálisis diafragmática (C3-C5), y pérdida de conciencia (tronco cerebral) 24
El tratamiento consiste en tranquilizar la paciente, oxígeno suplementario (intubación si se requiere para apoyar la oxigenación y ventilación por la pérdida de los reflejos de las vías respiratorias) y administración de líquidos por vía intravenosa más vasopresores como la efedrina o fenilefrina (puede requerirse adrenalina) para apoyar la presión arterial materna. El reconocimiento temprano es vital, ya que la progresión del bloqueo puede mitigarse ajustando la posición del paciente. Si se produce anestesia espinal total, colocar al paciente en una posición de Trendelenburg aumentará el retorno venoso y mejorará el gasto cardíaco.8 Si el paciente tiene una anestesia espinal alta (en comparación con una espinal total), no se recomienda la posición de Trendelenburg, ya que puede causar un aumento adicional del bloqueo que puede progresar a una espinal total. La sedación y la ventilación mecánica deben continuar hasta que haya evidencia de regresión de bloqueo en forma de función respiratoria espontánea adecuada y parámetros hemodinámicos estables.24
Desafíos comunes
Se utiliza un rango de concentraciones anestésicas (0.0625% -0.125% de bupivacaína) con opioides adicionales en volúmenes más grandes para establecer la analgesia epidural del parto. La administración de bupivacaína de baja concentración con opioides debe actuar como una dosis de prueba para detectar la colocación de catéter intravascular / intratecal.1
Los pacientes que requieren un bloqueo de reemplazo debido a la conversión fallida de la analgesia epidural de trabajo de parto a la anestesia quirúrgica ya tienen un volumen de líquido en el espacio epidural, que ejerce presión sobre el saco intratecal, causando diseminación cefálica de los medicamentos administrados por vía intratecal. Si se administra una dosis espinal estándar, puede ocurrir un bloqueo espinal alto (o total). Para evitar esta circunstancia, debe usarse una técnica basada en catéter (es decir, TEE) con un componente espinal de dosis reducida con la opción de respaldo para extender el bloqueo de manera segura dosificando el catéter epidural en caso de que se encuentre un bloqueo bajo.
La colocación involuntaria del catéter epidural en el espacio subdural puede conducir a un fallo de bloqueo o puede producir un bloqueo inesperadamente alto o irregular (generalmente de inicio lento de 20 a 35 minutos) 22. El bloqueo motor puede ser variable, la hipotensión no suele ser grave y los dermatomas sacros a menudo no se bloquean con la colocación de catéter subdural. Si se sospecha un bloqueo subdural, no se recomienda reiniciar la infusión epidural, ya que es probable que se desarrolle un bloqueo denso, por lo que se recomienda la extracción y el reemplazo del catéter epidural.
DOLOR DE ESPALDA
No existe una relación comprobada entre el uso de analgesia epidural y el dolor de espalda a largo plazo. 25 La mayor laxitud de los ligamentos debido a los niveles elevados de relaxina en el embarazo contribuye a la musculatura alterada, lo que puede provocar dolor de espalda. El dolor suele ser leve y auto limitado, aunque puede durar varias semanas. La analgesia simple y las compresas tibias o frías son suficientes para el alivio sintomático.8
ESCALOFRIO
El escalofrío es una ocurrencia común (hasta el 57%) durante el parto y después de la colocación del bloqueo neuroaxial.26 El mecanismo de temblor bajo anestesia neuroaxial no se conoce completamente; sin embargo, los posibles factores contribuyentes son una disminución de la temperatura central y la estimulación directa de los receptores de frío por los anestésicos locales.
Las consecuencias metabólicas y hemodinámicas de los escalofríos incluyen un mayor consumo de oxígeno y la producción de dióxido de carbono. El escalofrío es incómodo para el paciente y puede interferir con el monitoreo (electrocardiograma, presión arterial y saturación de oxígeno).11 El calentamiento de la piel con un calentador de aire forzado, mantener la temperatura ambiente adecuada, evitar la exposición prolongada de la piel y administrar líquidos intravenosos tibios puede ayudar a reducir los escalofríos. Se ha demostrado que la meperidina (0,35 mg / kg) es eficaz en casos resistentes.27
ANALGESIA INADECUADA
La incidencia precisa del bloqueo fallido después de anestesia espinal , epidural o TEE es desconocida, aunque una revisión retrospectiva informó una tasa general de fracaso del 12% para la analgesia del trabajo de parto y la anestesia.28 Existen varias técnicas que se pueden usar para rescatar un bloqueo inadecuado , que incluyen la optimización de la posición del paciente, la manipulación del catéter epidural y la administración de una dosis epidural en bolo (con o sin opioides neuroaxiales). La analgesia inadecuada del trabajo de parto a pesar de las intervenciones debe hacer que el anestesiólogo reemplace el catéter epidural.
PROGRESO TRABAJO DE PARTO
La analgesia neuroaxial puede alargar la segunda etapa del parto en aproximadamente 15 minutos, y la incidencia de parto vaginal instrumental aumenta, pero la tasa de cesárea no aumenta (independientemente de la etapa en la que se inicie la analgesia neuroaxial) 29.
EFECTOS SOBRE EL FETO Y EL RECIÉN NACIDO
Aunque los medicamentos atraviesan la placenta y pueden medirse en el neonato, los anestésicos locales no causan depresión neonatal ( cardiovascular, respiratoria o neurológica). Existe una relación temporal entre la velocidad de inicio de la analgesia del parto y la aparición (si existe) de la bradicardia fetal. La bradicardia fetal puede ocurrir después de la analgesia espinal (10 minutos) en comparación con la analgesia epidural (15-30 minutos). Las posibles etiologías incluyen hipotensión materna, hiperactividad uterina o aumento del tono uterino (30). Las implicaciones clínicas no están claras porque la aparición de cambios en la frecuencia cardíaca fetal en respuesta a la analgesia del parto no ha provocado un aumento en la tasa de parto intervencionista. Se cree que el posible mecanismo para aumentar el tono uterino está relacionado con un desequilibrio de las catecolaminas circulantes (predominio de la noradrenalina sobre la epinefrina) secundaria a la analgesia, favoreciendo la activación de los receptores del músculo liso. El útero hipertónico y la bradicardia fetal suelen ser de corta duración, aunque pueden aliviarse administrando nitroglicerina o un agonista b2. Los cambios observados en la frecuencia cardíaca fetal no se han correlacionado con la diferencia clínica observada en los resultados neonatales, incluidas las puntuaciones de Apgar, la prevalencia de pH del cordón umbilical – de 7.15 o el ingreso en cuidados intensivos neonatales.30
REFERENCIAS
- 3rd National Audit Project (NAP 3). National Audit of Major Complications of Central Neuraxial Block in the United Kingdom. London, UK: The Royal College of Anaesthetists; 2009. www.rcoa.ac.uk/nap3. Accessed April 2018.
- Sprigge JS, Harper SJ. Accidental dural puncture and post dural puncture headache in obstetric anaesthesia: presentation and management: a 23-year survey in a district general hospital. Anaesthesia. 2008;63:36-43.
- Gaiser RR. Postdural puncture headache: a headache for the patient and a headache for the anesthesiologist. Curr Opin Anaesthesiol. 2013;26:296-303.
- The Royal College of Anaesthetists. Raising the Standard: A Compendium of Audit Recipes. 3rd ed. London, UK: The Royal College of Anaesthetists; 2012. www.rcoa.ac.uk/document-store/audit-recipe-book-3rd-edition-2012. Accessed August 2018.
- Goldszmidt E, Kern R, Chaput A, Macarthur A. The incidence and etiology of postpartum headaches: a prospective cohort study. Can J Anaesth. 2005;52:971-977.
- Paech MJ, Doherty DA, Christmas T, Wong CA; Epidural Blood Patch Trial Group. The volume of blood for epidural blood patch in obstetrics: randomised, blinded clinical trial. Anesth Analg. 2011;113:126-133.
- Perlas A, Chaparro LE, Chin KJ. Lumbar neuraxial ultrasound for spinal and epidural anesthesia: a systematic review and meta-analysis. Reg Anesth Pain Med. 2016;41:251-260.
- Agarwal A, Kishore K. Complications and controversies of regional anaesthesia: a review. Indian J Anaesth. 2009;53:543- 553.
- Jadon A. Complications of regional and general anaesthesia in obstetric practice. Indian J Anaesth. 2010;54:415-420.
- Camann W. Obstetric neuraxial anesthesia contraindicated? Really? Time to rethink old dogma. Anesth Analg. 2015;121:846-848.
- D’Angelo R, Smiley RM, Riley ET, Segal S. Serious complications related to obstetric anesthesia: the serious complication repository project of the Society for Obstetric Anesthesia and Perinatology. Anesthesiology. 2014;120:1505-1512.
- Association of Anaesthetists of Great Britain and Ireland, Obstetric Anaesthetists’ Association, Regional Anaesthesia UK, Association of Paediatric Anaesthetists of Great Britain and Ireland; Campbell JP, Plaat F, Checketts MR, et al. Safety guideline: skin antisepsis for central neuraxial blockade. Anaesthesia. 2014;69:1279-1286.
- Kindler CH, Seeberger MD, Staender SE. Epidural abscess complicating epidural anesthesia and analgesia: an analysis of the literature. Acta Anaesthesiol Scand. 1998;42:614-620.
- Baldini G, Bagry H, Aprikian A, Carli F. Postoperative urinary retention: anesthetic and perioperative considerations. Anesthesiology. 2009;110:1139-1157.
- Mercier FJ, Bonnet MP, De la Dorie A, et al. Spinal anaesthesia for caesarean section: fluid loading, vasopressors and hypotension. Ann Fr Anesth Reanim. 2007;26:688-693.
- Dyer RA, Farina Z, Joubert IA, et al. Crystalloid preload versus rapid crystalloid administration after induction of spinal anaesthesia (coload) for elective caesarean section. Anaesth Intensive Care. 2004;32:351-357.
- Ngan Kee WD. The use of vasopressors during spinal anaesthesia for caesarean section. Curr Opin Anaesthesiol. 2017;30:319-325.
- Langesaeter E, Dyer RA. Maternal haemodynamic changes during spinal anaesthesia for caesarean section. Curr Opin Anaesthesiol. 2011;24:242-248.
- Christie LE, Picard J, Weinberg GL. Local anaesthetic systemic toxicity, Continuing Education in Anaesthesia Critical Care & Pain. 2015;15:136-142.
- Balki M, Carvalho JC. Intraoperative nausea and vomiting during cesarean section under regional anesthesia. Int J Obstet Anesth. 2005;14:230-241.
- Carvalho B. Respiratory depression after neuraxial opioids in the obstetric setting. Anesth Analg. 2008;107:956-961.
- Dahl JB, Jeppesen IS, Jorgensen H, Wetterslev J, Møiniche S. Intraoperative and postoperative analgesic efficacy and adverse effects of intrathecal opioids in patients undergoing cesarean section with spinal anesthesia: a qualitative and quantitative systematic review of randomized controlled trials. Anesthesiology. 1999;91:1919-1927.
- Balestrieri PJ, Ferguson JE II. Management of a parturient with a history of local anaesthetic allergy. Anesth Analg. 2003;96:1489-1490.
- Newman B. Complete spinal block following spinal anaesthesia. Anaesthesia Tutorial of the Week. 2010;180.
- Howell CJ, Kidd C, Roberts W, et al. A randomised controlled trial of epidural compared with non-epidural analgesia in labour. BJOG. 2001;108:27-33.
- Jeon YT, Jeon YS, Kim YC, Bahk JH, Do SH, Lim YJ. Intrathecal clonidine does not reduce post-spinal shivering. Acta Anaesthesiol Scand. 2005;49:1509-1513.
- Kurz A, Ikeda T, Sessler DI, Larson MD, Bjorksten AR. Meperidine decreases the shivering threshold twice as much as the vasoconstriction threshold. Anesthesiology. 1997;86:1046-1054.
- Pan PH, Bogard TD, Owen MD. Incidence and characteristics of failures in obstetric neuraxial analgesia and anaesthesia: a retrospective analysis of 19,259 deliveries. Int J Obstet Anesth. 2004;13:227-233.
- Grant EN, Tao W, Craig M, McIntire D, Leveno K. Neuraxial analgesia effects on labour progression: facts, fallacies, uncertainties and the future. BJOG. 2015;122:288-293.
- Littleford J. Effects on the fetus and newborn of maternal analgesia and anesthesia: a review. Can J Anaesth. 2004;51:586-609.



