Obstetric Anaesthesia
PONTOS-CHAVE
- As principais complicações após o bloqueio neuraxial em pacientes obstétricas (em comparação aos não-obstétricos) ocorrem relativamente com menor frequência por causa da saúde da paciente e da duração mais curta da cateterização epidural.
- A cefaleia pós-parto ocorre em 39% das pacientes na primeira semana; contudo, < de 5% se deve a cefaleia pós-punção dural.
- O tratamento conservador da cefaleia pós-punção dural não está bem comprovado. O tratamento definitivo envolve a administração de um tampão sanguíneo epidural.
- A maioria das neuropatias pós-parto devem-se a causas não-anestésicas (isto é, relacionadas à obstetrícia).
- Déficits neurológicos após bloqueios neuraxiais devem ser sempre completamente investigados.
- A administração intravenosa de solução de emulsão lipídica a 20% tem avançado significativamente no tratamento da toxicidade sistêmica de anestésico local.
INTRODUÇÃO
Complicações mais sérias ocorrem com menos frequência após uma anestesia neuraxial em pacientes obstétricas, em comparação com pacientes não-obstétricos, o que provavelmente está relacionado ao estado de saúde de pacientes obstétricas e à duração mais curta da cateterização epidural.¹ As complicações relacionadas a bloqueio neuraxial estão listadas na Tabela.
COMPLICAÇÕES NEUROLÓGICAS
O terceiro Projeto de Auditoria Nacional (NAP 3), publicado pelo Colégio Real de Anestesistas do Reino Unido, investigou a incidência de dano permanente no paciente como resultado de complicações após bloqueios neuraxiais e relatou 12 casos relacionados a anestesia obstétrica.¹ Cinco desses casos tiveram uma rápida e completa recuperação, enquanto 7 casos foram considerados como tendo uma complicação possivelmente ¹ A incidência mais alta de dano permanente foi relatada em pacientes adultos (não-obstétricos) perioperatórios.¹

Tabela. Visão geral de complicações da anestesia neuraxial
CEFALEIA PÓS-PUNÇÃO DURAL
Incidência
A punção dural pode ser intencional com uma agulha espinhal (ou técnica combinada espinhal-epidural [CEE]) ou não-intencional, com uma agulha Tuohy (epidural ou técnica CEE), que pode levar à cefaleia pós-punção dural (CPPD). A incidência da CPPD usando uma agulha espinhal (bisel de corte) Quincke de 27G a 30G é 3,5%, e a incidência com uma agulha espinhal de ponta de lápis de 26G é 0,8%.² O risco de punção não-intencional da dura com uma agulha Tuohy de 16G é de aproximadamente 0,91%, dos quais 88% dos casos sentirão CPPD (2). A incidência de CPPD após uma punção não-intencional da dura com uma agulha Touhy de 18G é 64%.³ O Colégio Real de Anestesistas sugerem que uma taxa aceitável de punção dural não-intencional durante a colocação de catéter epidural é <1%.4
Patofisiologia e Diagnóstico
O vazamento de líquido cefalorraquidiano (LCR) por meio de punção dural causa uma diminuição na pressão intracraniana; o mecanismo pelo qual isso causa uma cefaleia não está totalmente esclarecido. Pode ser por causa de tração das estruturas cranianas sensíveis à dor ou devido ao esgotamento do volume do LCR, o que induz a vasodilatação cerebral compensatória (a doutrina Monro-Kellie), e ativação de receptores de adenosina pode causar vasodilatação cerebral. Os fatores de risco para desenvolvimento da CPPD incluem pouca idade, gênero feminino, gravidez, histórico anterior, parto vaginal, e cuidador com experiência limitada.3
Os critérios diagnósticos para a CPPD conforme definidos pela Sociedade Internacional de Cefaleia (www.ichd-3.org) incluem os seguintes:
- Critérios para cefaleia atribuídos a pouca pressão do LCR e critério “c” abaixo
- Punção dural tenha sido feita
- Cefaleia tenha se desenvolvido até 5 dias após a punção dural
- Não mais bem explicada por outro diagnóstico da Classificação Internacional dos Transtornos de Cefaleia (3ª edição)
Diagnóstico Diferencial
Na primeira semana pós-parto, até 39% das pacientes descreverão sintomas de cefaleia, independentemente de terem recebido bloqueio neuraxial. Alterações hormonais, estado de jejum/hidratação, cansaço, e abstinência de cafeína podem causar cefaleia. Mais de 75% das cefaleias pós-parto têm uma causa primária, como enxaqueca, cefaleia de tensão, cervicogênica e em salvas.5 Cefaleias secundárias no período pós-parto são devidas a complicações da anestesia neuraxial (p.ex.: CPPD), doença obstétrica (p.ex.: transtornos hipertensivos), ou patologia intracraniana (p.ex.: trombose venosa cerebral). A CPPD corresponde a apenas 4,7% das cefaleias pós-parto, com a maioria sendo ao menos de gravidade moderada.5
Tratamento
Repouso e hidratação são geralmente recomendados para a CPPD, mas sua eficácia não está bem comprovada. O tratamento sintomático da CPPD com analgésicos (paracetamol, drogas não-esteroides anti-inflamatórias), antieméticos, e bloqueio do gânglio esfenopalatino (BGEP) tópico pode controlar sintomas e reduzir a necessidade para um tratamento mais agressivo; contudo, eles não têm efeito sobre o vazamento do LCR por meio da punção dural. Os BGEPs funcionam mediando a vasodilatação intracraniana via gânglio parassimpático do nervo craniano VII. Até hoje, apenas estudos retrospectivos e séries de caso foram publicadas, então, amplos estudos prospectivos são necessários para avaliar se os BGEPs podem substituir a necessidade de um tampão sanguíneo epidural (TSE). Alguns profissionais médicos recomendam o uso de 500mg cafeína intravenosa (IV) para tratamento sintomático da CPPD; contudo, as evidências não são convincentes. A cafeína tem um efeito vasoconstritor e reduz o fluxo sanguíneo cerebral.³
O tratamento definitivo para a CPPD é um, que envolve a injeção de sangue autólogo no espaço epidural, idealmente no mesmo nível vertebral ou um nível abaixo da punção original (por um anestesista experiente). O mecanismo postulado para a sua efetividade na redução dos sintomas é um aumento inicial da pressão no canal neuraxial lombar, que comprime o saco tecal. Essa pressão aumentada desloca o LCR do canal espinhal para o crânio,3 e o benefício terapêutico é atribuído à formação de um coágulo sobre o local da punção, prevenindo vazamento adicional do LCR.3 O volume ideal de sangue ainda não foi determinado; entretanto, recomenda-se tentar injetar 20 ml de sangue.6 Se a paciente sentir uma resolução dos sintomas, ou desenvolver dor nas costas ou nas pernas, a injeção deve ser interrompida antes de se chegar ao limite de 20 ml.
Implicações Anestésicas
Para anestesias espinhais, recomenda-se o uso de uma agulha de ponta de lápis de pequeno calibre (em oposição a uma agulha de corte), por causa da menor incidência de CPPD.
Para epidurais (ou CEEs), se ocorrer uma punção não-intencional da dura com uma agulha Touhy, as formas recomendadas de se proceder incluem as seguintes:
- Se tiver sido difícil localizar o espaço epidural, considere inserir o catéter epidural por via intratecal através da agulha Touhy.
- Se a colocação do catéter epidural não tiver sido difícil, tente recolocar ou considere inserir o catéter epidural por via intratecal.³
Há várias questões que precisam ser levadas em consideração ao se determinar qual técnica é apropriada e a mais segura a se seguir após uma punção não-intencional da dura.
Vantagens de se introduzir o catéter por via intratecal:
- A colocação intratecal do catéter evita a necessidade de buscar outro local e a possibilidade de uma punção dural subsequente ou outras complicações relacionadas à punção.
- Rápido início de ação da analgesia.
Desvantagens de se introduzir o catéter por via intratecal:
- O catéter intratecal pode ser confundido com um catéter epidural e dosado/em bolus de maneira inapropriada
- Possivelmente um maior risco de meningite, pois o catéter está mais próximo do sistema nervoso central³
- Possibilidade de desconexão acidental de um catéter com perda de LCR³
- Incidência mais alta de migração de catéter e fracasso em estágios mais avançados do trabalho de parto
Desafios Comuns
A hipotensão craniana e o vazamento crônico do LCR podem distender as veias-ponte cerebrais que podem romper e levar a hematoma subdural ou subaracnoide crônica. O vazamento crônico também pode raramente causar paralisias nervosas cranianas devido ao suprimento sanguíneo alterado, e o nervo craniano mais afetado é o VI, atribuível à sua longa extensão intracraniana.
DANO NERVOSO
Incidência
A incidência de dano nervoso permanente após bloqueio neuraxial obstétrico está entre 1:80.000 e 1:320.425.¹ Etiologias relacionadas à obstetrícia (não-anestésicas) corresponde à maioria das neuropatias pós-parto.
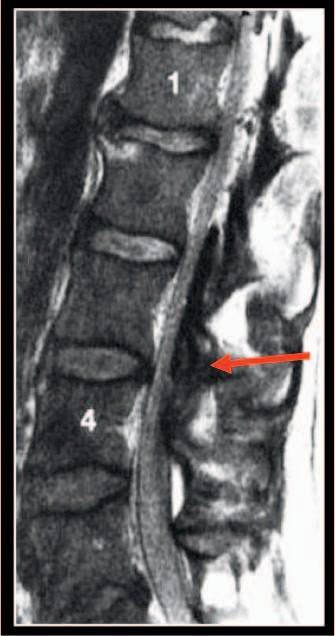
Figura 1. Hematoma do canal vertebral. A seta aponta para o hematoma (1).
Patofisiologia e Diagnóstico
O trauma direto ao tecido nervoso por uma agulha espinhal ou epidural pode ocorrer ao nível da medula espinhal ou raiz nervosa. A maioria dos casos de lesão nervosa traumática está associada a parestesia ou inserção de agulha. Dor, parestesia, e fraqueza motora na distribuição de um nervo podem não ser clinicamente evidentes até que o bloqueio tenha regredido. Sintomas agudos podem não necessariamente estar relacionados à técnica neuraxial, mas podem representar a apresentação inicial de uma doença neurológica de início recente, que exigirá mais investigação.
Tratamento
A maioria dos pacientes que sofrem uma lesão nervosa traumática têm recuperação completa; todavia, é sempre importante acompanhar pacientes que sofreram uma lesão.
Desafios Comuns
O cone medular se estende abaixo da L1-2 em aproximadamente 20% de adultos, então, a anestesia espinhal sempre deve ser colocada abaixo do nível da L3. O ultrassom neuraxial pré-punção pode ser usado para guiar a colocação em um nível vertebral apropriado. A literatura sugere que o ultrassom facilita a colocação do bloqueio neuraxial em casos difíceis ao reduzir o tempo gasto e o número de tentativas.7 Não há dados sugerindo que o uso de ultrassom diminui a incidência de complicações.
HEMATOMA DO CANAL VERTEBRAL
Hematomas epidurais e espinhais são complicações raras, mas potencialmente catastróficas do bloqueio neuraxial. A incidência relatada é de 1:150.000 para um hematoma epidural, e 1:220.000 para um hematoma espinhal.8 Os riscos associados a essas complicações incluem gênero feminino, idade avançada, colocação traumática da agulha/catéter, e colocação ou remoção do catéter em pacientes em terapia anticoagulante.8
O hematoma agudo do canal vertebral geralmente se apresenta com dor nas costas de início rápido, geralmente de natureza radicular com déficits motores e sensoriais abaixo do nível de qualquer compressão associada da medula espinhal.
Quando uma infusão epidural é interrompida por causa de uma preocupação clínica sobre a densidade do bloqueio, a recuperação deve ocorrer em até 4 horas e deve ser progressiva.¹ Se este não for o caso, deve-se realizar exames de imagem (ressonância magnética [RM]) imediatamente (Figura 1).¹ A descompressão cirúrgica em até 8 a 12 horas do início dos sintomas pode resultar em boa recuperação neurológica.9
Caso haja suspeita de hematoma do canal vertebral, recomenda-se excluir o diagnóstico antes de remover um catéter epidural. As observações neurológicas devem continuar por 24 horas após a remoção de um catéter epidural, e por mais tempo, caso a paciente permaneça imóvel.1
Recomendações
A maioria dos clínicos ficam confortáveis colocando um bloqueio neuraxial quando a contagem de plaquetas é maior que 80.000/mm3 A razão risco-benefício em um cenário de trombocitopenia pode ser considerada em uma faixa, por exemplo, > 70-80.000/mm³, na qual o bloqueio neuraxial geralmente é considerado seguro. Na faixa de 50-70.000/mm³, deve-se considerar uma avaliação mais cuidadosa das circunstâncias individuais relacionadas à paciente, e para contagem < 50.000/mm³, a razão risco-benefício geralmente, mas nem sempre, favorece evitar o bloqueio neuraxial.10 Não é apenas a avaliação quantitativa das plaquetas que é significante, mas também a avaliação qualitativa (função das plaquetas) e a taxa de declínio (p.ex.: em trombocitopenia gestacional, trombocitopenia idiopática, púrpura trombocitopênica trombótica, pré-eclâmpsia, e septicemia).
Histórico da paciente a o exame para se identificar sintomas e/ou sinais de trombocitopenia também são importantes de se levar em consideração. Em pacientes obesas com o estômago cheio, pacientes com previsão de vias aéreas difíceis, ou pacientes com pré-eclâmpsia, por exemplo, uma contagem mais baixa de plaquetas pode ser mais aceitável quando se considera os riscos de anestesia geral em comparação à anestesia regional. O uso de anestésicos locais de baixa concentração para analgesia no trabalho de parto pode ajudar pacientes que têm um risco mais alto de desenvolver um hematoma, porque, se elas desenvolveram um bloqueio motor denso, as investigações/exames de imagem podem ser solicitados precocemente.
ABCESSO EPIDURAL
A incidência de abcesso epidural é relatada como 1:62.866 na população obstétrica.11 A formação de abcesso epidural resulta da semeadura bacteriana hematogênica do espaço epidural ou da contaminação com flora da pele.12 Staphylococcus são os agentes etiológicos mais frequentes (57%), seguidos de streptococcus (18%) e bacilos Gram-negativos (13%).13 As características clínicas de um abcesso epidural geralmente começam vários dias depois do bloqueio neuraxial, mas a apresentação pode demorar até vários meses. Os sintomas incluem dor nas costas, pirexia, mal-estar, sinais de compressão da medula (alterações sensoriais, paralisia flácida seguida de paralisia espástica), contagem elevada de leucócitos, e contagem elevada de proteínas e leucócitos no LCR.1 Há uma alta variabilidade interindividual na apresentação e taxa de deterioração neurológica, e a tríade clássica (dor nas costas, febre, e déficit neurológico) geralmente não é encontrada.¹
A ressonância magnética com gadolínio é o método de imagem mais sensível e específico.¹ O tratamento de um abcesso epidural envolve terapia prolongada com antibióticos (geralmente 4-6 semanas) e possível drenagem cirúrgica.12 Os Antibióticos incluem agentes ativos contra Staphylococcus aureus, incluindo organismos resistentes à meticilina, e organismos anaeróbicos/Gram-negativos, especialmente em pacientes com histórico de abuso de drogas intravenosas. Um regime sugerido com três agentes é vancomicina, metronidazol e cefotaxima.
MENINGITE
A incidência estimada de meningite após bloqueio neuraxial é menor que 1:200.000.¹ A meningite bacteriana pode ocorrer por causa de equipamento contaminado ou semeadura bacteriana hematogênica após bloqueio neuraxial. Após anestesia espinhal/CEE ou punção lombar diagnóstica, comensais nasofaríngeos (p.ex.: Streptococcus) foram identificados, o que sugere uma disseminação por gotículas da via aérea do anestesista com transferência direta para o LCR. Os sintomas da meningite geralmente se desenvolvem 24 a 48 horas após o bloqueio neuraxial, e o prognóstico de meningite bacteriana é geralmente bom se antibióticos apropriados forem iniciados logo.
A anestesia espinhal em pacientes com infecção coexistente é um tema controverso. Em pacientes com evidencia de bacteremia, recomenda-se que sejam administrados antibióticos (com evidências de resposta) antes de se realizar o bloqueio neuraxial.¹
Recomendações
A Associação de Anestesistas da Grã-Bretanha e Irlanda recomenda uma preparação da pele com 0,5% de gluconato de clorexidina em álcool 70% (permitindo tempo de secagem adequado) antes de toda intervenção anestésica neuraxial, para reduzir a incidência de complicações infecciosas (Figura 2).12 Na América do Norte, é prática mais comum usar gluconato de clorexidina 2% a 3% em álcool 70%. Também deve haver ênfase em lavagem meticulosa das mãos e preocupações estéreis.12
ARACNOIDITE
Há evidências limitadas na literatura de aracnoidite após anestesia neuraxial obstétrica. Há alguns poucos relatos de casos em que a aracnoidite se desenvolveu após a injeção não-intencional de clorexidina no espaço espinhal e/ou epidural. As pacientes geralmente se apresentam com dor na parte inferior das costas, disestesia, e parestesia que não seguem a distribuição de dermátomos habitual.10

Figura 2. Gluconato de clorexidina 0,5% em álcool 70% para preparação da pele (1).
SÍNDROME NEUROLÓGICA TRANSITÓRIA (SNT)
SNT é uma síndrome de dor e disestesia nas nádegas, coxas ou panturrilhas que pode ocorrer após anestesia espinhal. É autolimitante e geralmente se resolve em até 72 horas. A lidocaína tem sido implicada na maioria dos casos, mas descobriu-se que a bupivacaína causa SNT leve com características clínicas sutis. A SNT não é normalmente associada a qualquer patologia neurológica.11
RETENÇÃO URINÁRIA
A anestesia neuraxial bloqueia as raízes nervosas S2-S4, diminui o tônus da bexiga urinária, e inibe o reflexo de esvaziamento; portanto, agentes anestésicos locais de longa duração que requerem um período mais longo para a função da bexiga se recuperar apresentam maior risco de retenção urinária.14 Os opióides espinhais também influenciam a função da bexiga e causam retenção urinária.14
AVALIAÇÃO DE DÉFICITS NEUROLÓGICOS
A maioria das neuropatias pós-parto devem-se a causas não-anestésicas (isto é, relacionadas à obstetrícia). O histórico, exames neurológicos, investigações diagnósticas e tratamento apropriados em um ambiente multidisciplinar envolvendo um neurologista devem minimizar o risco de lesão neurológica permanente. O agravamento dos sintomas neurológicos ou a apresentação após um período sem sintomas deve ser revisada imediatamente. Um exame neurológico completo, incluindo a avaliação dos nervos cranianos e sinais de septicemia concomitante é essencial. Mapear os sintomas do paciente podem revelar um padrão consistente com uma lesão nervosa periférica.
Investigações laboratoriais de rotina, incluindo hemograma completo, culturas sanguíneas, e triagem de coagulação, devem ser realizadas se houver suspeita dos diagnósticos de abcesso epidural, meningite ou hematoma. Investigações mais invasivas como punção lombar são benéficas quando se suspeita de meningite. A ressonância magnética (com ou sem gadolínio) pode revelar inchaço na medula espinhal e áreas de inflamação.¹ Investigações eletrofisiológicas podem diferenciar entre lesão nervosa central e periférica, identificar os músculos afetados, dar um prognóstico provável de recuperação neuronal e dar uma estimativa temporal quanto ao provável tempo da lesão (que é de particular importância em relação a possíveis processos jurídicos).
É importante realizar histórico e exames complementares antes da anestesia neuraxial e documentar quaisquer neuropatias pré-existentes, de forma que quaisquer sintomas e/ou sinais que se desenvolvam após o procedimento possam ser diferenciados entre agudos e crônicos.
COMPLICAÇÕES CARDIOVASCULARES
A simpatectomia química oriunda de bloqueio neuraxial pode ser exagerada por alterações fisiológicas da gravidez, levando a hipotensão em 55% a 90% das pacientes que recebem anestesia espinhal para cesárea.15 A diminuição da pré-carga após anestesia espinhal pode iniciar reflexos (p.ex.: reflexo de Behold-Jarisch, reflexo de estiramento do marcapasso, e barorreceptores de baixa pressão) que causam bradicardia.
Um rápido bolus de cristaloide IV ao mesmo tempo da administração da anestesia espinhal (co-carga) é mais efetivo em manter a pressão sanguínea maternal em comparação à pré-carga.16 A administração de vasopressores também podem reduzir a resposta hipotensiva. As evidências atuais apoiam a fenilefrina em vez da efedrina como o vasopressor de primeira linha, que pode ser administrada por bolus ou infusão (50 μg/min ou 0,5 μg/kg/min), embora a infusão profilática de fenilefrina também tenha se mostrado mais efetiva.17,18 Um foco de pesquisa atual é a investigação de outros agentes, com interesse particular em noradrenalina como uma alternativa efetiva à fenilefrina, que tem a vantagem de manter uma frequência cardíaca e débito cardíaco estáveis.17
TOXICIDADE SISTÊMICA DO ANESTÉSICO LOCAL (TSAL)
Altas concentrações de plasma de anestésicos locais podem causar toxicidade do sistema nervoso central (SNC) e cardiovascular. Estudos relataram uma incidência de TSAL de 1,2 a 11 a cada 10.000 anestésicos epidurais.19 O NAP 3 identificou 11 casos de administração em rota errada de anestésicos locais no Reino Unido em um período de 1 ano, e 6 envolveram a injeção IV de bupivacaína.¹ A TSAL pode ocorrer por causa de injeção IV acidental ou absorção sistêmica vinda do espaço epidural. A incidência de toxicidade pode ser reduzida pela administração de uma dose de teste (com ou sem adrenalina) para descartar a colocação intravascular, aspirando o catéter epidural antes da injeção, administrando anestésicos locais com baixos perfis de toxicidade, usando regimes de dosagens incrementais, e usando um catéter epidural com ponta macia. O uso de uma dose de teste contendo adrenalina para descartar a colocação intravascular durante o trabalho de parto é discutível, já que as pacientes exibirão taquicardia devido às contrações e dor. Aspirar o catéter epidural para identificar sangue/LCR pode dar resultados falsos negativos, então, cada vez que o catéter for dosado (e durante toda a duração da infusão epidural), as pacientes devem ser observadas para evidências de sintomas e sinais de administração intravascular/intratecal de anestésico local.
As características da TSAL no SNC incluem parestesia perioral, inquietação que pode progredir para convulsões, insuficiência respiratória, e inconsciência. A toxicidade cardiovascular geralmente começa após os sinais de toxicidade do SNC, e podem se apresentar com bradicardia extrema ou arritmia ventricular (maligna) que pode levar a parada cardíaca refratária. A administração de solução IV de emulsão lipídica 20% avançou significativamente o tratamento da TSAL.19
EFEITOS COLATERAIS RELACIONADOS À DROGAS
Náusea e Vômito
A incidência de náusea e vômito durante uma cesárea pode ser de até 80%, dependendo da técnica anestésica utilizada (espinhal, epidural ou CEE), e se foram tomadas medidas preventivas ou terapêuticas.20 A etiologia é multifatorial e inclui a redução induzida por progesterona do tônus do esfíncter esofágico inferior, pressão intragástrica aumentada, hipotensão, exteriorização do útero, estimulação visceral, e uso de opióides neuraxiais. A incidência é maior com opioides hidrofílicos como a morfina, e pode ser reduzida a 7% com fentanil. 20 Medidas preventivas incluem deslocamento uterino à esquerda, pré-carga de fluido intravenoso, uso de vasopressores, dose ideal de opioide(s) neuraxiais, evitar opioides parentais, lenta administração de medicação(ões) uterotônica(s), administração de vagolíticos e antieméticos, evitar estimulação cirúrgica excessiva, e movimentação mínima.20 Medidas terapêuticas incluem a administração de medicação(ões) antiemética(s).
Depressão Respiratória
Estudos não-obstétricos relatam uma incidência de depressão respiratória após a administração de opioides neuraxiais de 0,01% a 7%.21 Na população obstétrica, embora os opióides neuraxiais estejam associados a um risco muito baixo de depressão respiratória clinicamente significativa, ela de fato ocorre e pode ter consequências fatais.1,21
A depressão respiratória após a administração neuraxial de morfina é bifásica: pode ocorrer cedo, de 30 a 90 minutos após a administração, mais provavelmente por causa de absorção sistêmica, ou tardiamente, de 6 a 18 horas, devido a disseminação rostral (dadas as características hidrofílicas da morfina) no LCR do tronco cerebral. A diamorfina intratecal (300-400 μg) é recomendada para analgesia pós-operatória após cesárea em preferência à morfina, já que é mais lipofílica; contudo, a diamorfina não está disponível na América do Norte.
PRURIDO
A incidência e gravidade do prurido são dependentes da dose de opióides, e ele ocorre mais frequentemente após administração intratecal em comparação com administração epidural (58% x 30%).22 A causa não é bem compreendida, mas provavelmente não está relacionada à liberação de histamina. Há cada vez mais evidências de que o prurido induzido por opióides é mediado por meio de receptores μ centrais. Os antagonistas de opióides (p.ex.: naloxona) ou agonistas-antagonistas parciais (p.ex.: nalbufina) são efetivos em aliviar o prurido, e a naloxona IV pode ser administrada em doses tituladas iniciando com 40 μg.
ANAFILAXIA
Os opióides como a petidina (chamada meperidina na América do Norte), a codeína e a morfina são gatilhos potentes de liberação de histamina, e a maioria das reações são leves e não-alérgicas, apresentando prurido e urticária apenas. As reações mediadas por imunoglobina E (IgE) raramente ocorrem. A adição de opióides a soluções de anestésicos espinhais melhora a densidade do bloqueio e fornece analgesia pós-operatória. Contudo, pacientes com uma alergia significativa a opioides devem evitar esses agentes.
A alergia a anestésico local é frequentemente relatada por pacientes, mas a incidência real de reação alérgica mediada por IgE é menor que 1%.23 Anestésicos locais à base de ésteres são mais propensos do que as amidas a provocar uma reação alérgica do tipo 4. O tratamento de uma paciente com histórico de alergia a anestésicos locais representam um desafio significativo para o anestesista obstétrico. Um teste de pele pode induzir anafilaxia, embora tal reação a anestésicos locais seja muito rara. O tratamento de casos tão complicados e difíceis deve ser feito em colaboração estreita com especialistas em alergia e as equipes de atenção obstétrica e anestésica.23 O teste de alergia deve idealmente ser realizada durante pré-gravidez, ou após o parto, mas se for julgado necessário realizar durante a gravidez (circunstância muito rara), deve ser realizado quando o feto é viável, em caso de parto de emergência.
OUTRAS
Espinhal Alta (Total)
O bloqueio espinhal completo é causado por anestésico local interferindo com a função neuronal normal na medula espinhal cervical e no tronco cerebral. Para minimizar o risco de anestesia espinhal alta ou total, certos fatores precisam ser considerados, o que inclui fatores da droga (p.ex.: dose, baricidade ou administração epidural anterior [v. a seção ‘Desafios Comuns’]), fatores do paciente (p.ex.: morfologia corporal, anormalidade anatômica) e fatores da técnica (p.ex.: local da inserção, posição do paciente após o bloqueio, calibre da agulha, e direção durante a injeção). 24
As manifestações clínicas variam com a altura do bloqueio e incluem dispneia secundária a paralisia do músculo intercostal (T1-T12), bradicardia e hipotensão (T1-T4), parestesia nas mãos (T1), parada respiratória secundária a paralisia diafragmática (C3-C5), e perda de consciência (tronco cerebral). 24
O tratamento consiste em reanimação, oxigênio suplementar (intubação se necessária para suportar oxigenação e ventilação ou por perda dos reflexos das vias aéreas), e administração de fluido IV mais vasopressores como efedrina ou fenilefrina (adrenalina pode ser necessária) para aumentar a pressão arterial materna. O reconhecimento precoce é vital, já que o progresso do bloqueio pode ser mitigado ajustando-se a posição da paciente. Se ocorrer anestesia espinhal total, colocar a paciente em uma posição de Trendelenburg aumentará o retorno venoso e melhorará o débito cardíaco.8 Se a paciente tiver uma espinhal alta (em comparação com uma espinhal total), a posição de Trendelenburg não é recomendada, pois pode causar um elevação ainda maior do bloqueio, que pode progredir para uma espinhal total. A sedação e ventilação mecânica precisam continuar até que haja evidência de regressão do bloqueio na forma de função respiratória espontânea adequada e parâmetros hemodinâmicos estáveis. 24
Desafios Comuns
Uma variedade de concentrações anestésicas (bupivacaína 0,0625%-0,125%) com opióide adicional são usadas em volumes maiores para estabelecer analgesia epidural no trabalho de parto. A administração de bupivacaína de baixa concentração com opióide deve por si só agir como uma dose de teste para detectar a colocação intravascular/intratecal do catéter.
Pacientes que precisam de um bloqueio substituto devido a uma falha na conversão da analgesia epidural do trabalho de parto para anestesia cirúrgica já têm um volume de fluido no espaço epidural, que exerce pressão sobre o saco intratecal, causando dispersão cefálica de medicações administradas por via intratecal. Se uma dose espinhal padrão for administrada, pode ocorrer um bloqueio espinhal alto (ou total). Para evitar essa circunstância, uma técnica baseada em catéter deve ser usada (isto é, CEE), com um componente espinhal de dose reduzida E a opção de se estender o bloqueio com segurança dosando o catéter epidural caso seja encontrado um bloqueio baixo.
A colocação inadvertida do catéter epidural no espaço subdural pode levar a falha no bloqueio ou pode produzir um bloqueio inesperadamente alto ou irregular (geralmente com início de ação lento de 20-35 minutos).22 O bloqueio motor pode ser variável, a hipotensão geralmente não é severa, e dermátomos sacrais frequentemente são poupados com a colocação de um catéter subdural. Caso haja suspeita de um bloqueio subdural, não se recomenda reiniciar a infusão epidural, pois o desenvolvimento adicional de um bloqueio denso é provável; então, a remoção e substituição do catéter epidural é recomendada.
DOR NAS COSTAS
Não há relação comprovada entre o uso de analgesia epidural e dor nas costas a longo prazo.25 O relaxamento aumentado dos ligamentos devido a níveis elevados de relaxina na gravidez contribuem para uma musculatura alterada, que pode levar a dor nas costas. A dor é geralmente leve e autolimitada, embora possa durar várias semanas. Uma analgesia simples e compressas mornas ou frias são suficientes para o alívio sintomático.8
TREMOR
O tremor é uma ocorrência comum (até 57%) durante o trabalho de parto, e após a colocação de bloqueio neuraxial.26 O mecanismo do temor durante anestesia neuraxial não é completamente compreendido; contudo, possíveis fatores contribuintes são uma diminuição na temperatura central e estimulação direta de receptores frios por anestésicos locais.
As consequências metabólicas e hemodinâmicas do tremor incluem o consumo aumentado de oxigênio e maior produção dióxido de carbono. O tremor é desconfortável para a paciente e pode interferir com a monitoração (eletrocardiograma, pressão arterial, e saturação de oxigênio).11 O aquecimento da pele usando um aquecedor de ar forçado, manter a temperatura adequada na sala, evitar exposição prolongada da pele, e administrar os fluidos IV aquecidos podem ajudar a reduzir o tremor. A petidina (0,35 mg/kg) mostrou-se efetiva em casos resistentes. 27
ANALGESIA INADEQUADA
A incidência precisa de falha de bloqueio após uma técnica espinhal, epidural ou CEE é desconhecida, embora uma revisão retrospectiva tenha relatado uma taxa de fracasso geral de 12% de analgesia e anestesia no trabalho de parto.28 Há várias técnicas que podem ser usadas para resgatar um bloqueio inadequado, que incluem otimização da posição da paciente, manipulação do catéter epidural, e administração pelo médico de uma dose de bolus epidural (com ou sem opióides neuraxiais). A analgesia inadequada no trabalho de parto, apesar de intervenções, deve levar o anestesista a substituir o catéter epidural.
PROGRESSO DO TRABALHO DE PARTO
A analgesia neuroaxial pode estender o segundo estágio do trabalho de parto por aproximadamente 15 minutos, e a incidência de parto vaginal instrumental aumenta, mas a taxa de cesáreas não é aumentada (independentemente do estágio em que seja iniciada a analgesia neuroaxial).29
EFEITOS NO FETO E NO RECÉM-NASCIDO
Embora a medicação atravesse a placenta e possa ser medida no neonato, os anestésicos locais não causam depressão neonatal (isto é, cardiovascular, respiratória ou neurológica). Há uma relação temporal entre a velocidade de início da ação da analgesia no trabalho de parto e o surgimento (caso haja) de bradicardia fetal. A bradicardia fetal pode ocorrer mais cedo após a analgesia espinhal (<10 minutos) em comparação à analgesia epidural (15-30 minutos). As possíveis etiologias incluem hipotensão materna, hiperatividade uterina, ou tônus uterino aumentado (30). As implicações clínicas não estão claras, porque a ocorrência de alterações na frequência cardíaca fetal em resposta à analgesia no trabalho de parto não levou a um aumento da taxa de parto cirúrgico. O possível mecanismo para aumento do tônus uterino é visto como relacionado ao desequilíbrio de catecolaminas em circulação (a predominância de norepinefrina em vez de epinefrina) secundário à analgesia, favorecendo a ativação “a” em detrimento da “b” de receptores de músculos lisos. O útero hipertônico e a bradicardia fetal geralmente duram pouco, embora possam ser aliviados por meio da administração de nitroglicerina ou agonista b2. As alterações observadas na frequência cardíaca fetal não foram correlacionadas à diferença clínica observada em resultados neonatais, incluindo escores Apgar, a prevalência de pH do cordão <7,15, ou admissão a UTI neonatal.30
REFERÊNCIAS
- 3rd National Audit Project (NAP 3). National Audit of Major Complications of Central Neuraxial Block in the United Kingdom. London, UK: The Royal College of Anaesthetists; 2009. www.rcoa.ac.uk/nap3. Accessed April 2018.
- Sprigge JS, Harper SJ. Accidental dural puncture and post dural puncture headache in obstetric anaesthesia: presentation and management: a 23-year survey in a district general hospital. Anaesthesia. 2008;63:36-43.
- Gaiser RR. Postdural puncture headache: a headache for the patient and a headache for the anesthesiologist. Curr Opin Anaesthesiol. 2013;26:296-303.
- The Royal College of Anaesthetists. Raising the Standard: A Compendium of Audit Recipes. 3rd ed. London, UK: The Royal College of Anaesthetists; 2012. www.rcoa.ac.uk/document-store/audit-recipe-book-3rd-edition-2012. Accessed August 2018.
- Goldszmidt E, Kern R, Chaput A, Macarthur A. The incidence and etiology of postpartum headaches: a prospective cohort study. Can J Anaesth. 2005;52:971-977.
- Paech MJ, Doherty DA, Christmas T, Wong CA; Epidural Blood Patch Trial Group. The volume of blood for epidural blood patch in obstetrics: randomised, blinded clinical trial. Anesth Analg. 2011;113:126-133.
- Perlas A, Chaparro LE, Chin KJ. Lumbar neuraxial ultrasound for spinal and epidural anesthesia: a systematic review and meta-analysis. Reg Anesth Pain Med. 2016;41:251-260.
- Agarwal A, Kishore K. Complications and controversies of regional anaesthesia: a review. Indian J Anaesth. 2009;53:543- 553.
- Jadon A. Complications of regional and general anaesthesia in obstetric practice. Indian J Anaesth. 2010;54:415-420.
- Camann W. Obstetric neuraxial anesthesia contraindicated? Really? Time to rethink old dogma. Anesth Analg. 2015;121:846-848.
- D’Angelo R, Smiley RM, Riley ET, Segal S. Serious complications related to obstetric anesthesia: the serious complication repository project of the Society for Obstetric Anesthesia and Perinatology. Anesthesiology. 2014;120:1505-1512.
- Association of Anaesthetists of Great Britain and Ireland, Obstetric Anaesthetists’ Association, Regional Anaesthesia UK, Association of Paediatric Anaesthetists of Great Britain and Ireland; Campbell JP, Plaat F, Checketts MR, et al. Safety guideline: skin antisepsis for central neuraxial blockade. Anaesthesia. 2014;69:1279-1286.
- Kindler CH, Seeberger MD, Staender SE. Epidural abscess complicating epidural anesthesia and analgesia: an analysisof the literature. Acta Anaesthesiol Scand. 1998;42:614-620.
- Baldini G, Bagry H, Aprikian A, Carli F. Postoperative urinary retention: anesthetic and perioperative considerations. Anesthesiology. 2009;110:1139-1157.
- Mercier FJ, Bonnet MP, De la Dorie A, et al. Spinal anaesthesia for caesarean section: fluid loading, vasopressors and hypotension. Ann Fr Anesth Reanim. 2007;26:688-693.
- Dyer RA, Farina Z, Joubert IA, et al. Crystalloid preload versus rapid crystalloid administration after induction of spinal anaesthesia (coload) for elective caesarean section. Anaesth Intensive Care. 2004;32:351-357.
- Ngan Kee WD. The use of vasopressors during spinal anaesthesia for caesarean section. Curr Opin Anaesthesiol. 2017;30:319-325.
- Langesaeter E, Dyer RA. Maternal haemodynamic changes during spinal anaesthesia for caesarean section. Curr Opin Anaesthesiol. 2011;24:242-248.
- Christie LE, Picard J, Weinberg GL. Local anaesthetic systemic toxicity, Continuing Education in Anaesthesia Critical Care & Pain. 2015;15:136-142.
- Balki M, Carvalho JC. Intraoperative nausea and vomiting during cesarean section under regional anesthesia. Int J Obstet Anesth. 2005;14:230-241.
- Carvalho B. Respiratory depression after neuraxial opioids in the obstetric setting. Anesth Analg. 2008;107:956-961.
- Dahl JB, Jeppesen IS, Jorgensen H, Wetterslev J, Møiniche S. Intraoperative and postoperative analgesic efficacy and adverse effects of intrathecal opioids in patients undergoing cesarean section with spinal anesthesia: a qualitative and quantitative systematic review of randomized controlled trials. Anesthesiology. 1999;91:1919-1927.
- Balestrieri PJ, Ferguson JE II. Management of a parturient with a history of local anaesthetic allergy. Anesth Analg. 2003;96:1489-1490.
- Newman B. Complete spinal block following spinal anaesthesia. Anaesthesia Tutorial of the Week. 2010;180.
- Howell CJ, Kidd C, Roberts W, et al. A randomised controlled trial of epidural compared with non-epidural analgesia in labour. BJOG. 2001;108:27-33.
- Jeon YT, Jeon YS, Kim YC, Bahk JH, Do SH, Lim YJ. Intrathecal clonidine does not reduce post-spinal shivering. Acta Anaesthesiol Scand. 2005;49:1509-1513.
- Kurz A, Ikeda T, Sessler DI, Larson MD, Bjorksten AR. Meperidine decreases the shivering threshold twice as much as the vasoconstriction threshold. Anesthesiology. 1997;86:1046-1054.
- Pan PH, Bogard TD, Owen MD. Incidence and characteristics of failures in obstetric neuraxial analgesia and anaesthesia: a retrospective analysis of 19,259 deliveries. Int J Obstet Anesth. 2004;13:227-233.
- Grant EN, Tao W, Craig M, McIntire D, Leveno K. Neuraxial analgesia effects on labour progression: facts, fallacies, uncertainties and the future. BJOG. 2015;122:288-293.
- Littleford J. Effects on the fetus and newborn of maternal analgesia and anesthesia: a review. Can J Anaesth. 2004;51:586-609.



