General Topics
PONTOS-CHAVE
- A cirurgia robótica transoral é mais comumente usada para ressecção de câncer orofaríngeo, localização de tumores primários ocultos de cabeça e pescoço, e tratamento de ronco e apneia obstrutiva do sono.
- Uma via aérea potencialmente difícil é compartilhada com um robô, e o acesso intraoperatório ao paciente é limitado.
- Um protocolo de cirurgia robótica transoral local deve ser compartilhado entre as equipes cirúrgicas, de enfermagem e anestesia. Isso deve incluir um procedimento de desengate de emergência.
- Há o perigo de o robô causar lesões não-intencionais a estruturas ao redor, já que há supervisão direta limitada dos braços do robô durante o procedimento.
- A técnica anestésica deve permitir a natureza estimulante da cirurgia, e a analgesia multimodal baseada em opioides é exigida para dor pós-operatória potencialmente intensa.
- As complicações incluem hemorragia significativa, que pode levar a asfixia e aspiração.
INTRODUCÃO
A cirurgia robótica transoral (TORS) envolve o uso de um robô para realizar cirurgia minimamente invasiva na via aérea superior através da boca. A técnica foi primeiramente desenvolvida para permitir a ressecção de tumores orofaríngeos,¹ mas uma gama cada vez maior de indicações agora também inclui o tratamento cirúrgico da apneia obstrutiva do sono (SAOS), conhecida como TORSA (cirurgia robótica transoral para apneia do sono). Este tutorial fornecerá uma visão geral dos princípios por trás da TORS, e a gestão anestésica desses procedimentos.
ANTECEDENTES DA TORS
Os cirurgiões que operam através da boca com instrumentos convencionais ficam limitados pelos corredores de trabalho que ficam na linha de visão, e pelo espaço confinado disponível. A tecnologia robótica oferece ótica e instrumentação avançadas que podem melhorar a qualidade da visualização, a exposição, e a dissecção em espaços confinados. O robô Da Vinci (Intuitive Medical) é o mais comum, e tem sido usado em quase todos os trabalhos publicados sobre TORS. É um sistema telerrobótico que oferece uma interface completa entre o paciente e o cirurgião, que fica sentado em um console distante. Duas câmeras em um único endoscópio fornecem ao cirurgião uma visão ampliada tridimensional de alta definição do campo cirúrgico (Figura 1). Um braço robótico segura o endoscópio, e outro segura instrumentos manuseados com a mão direita e esquerda. O dimensionamento do movimento e a filtragem do tremor natural da mão humana resultam em uma suave destreza bimanual dentro do campo cirúrgico. Todos esses recursos permitem a excisão precisa do tecido tumoral.2
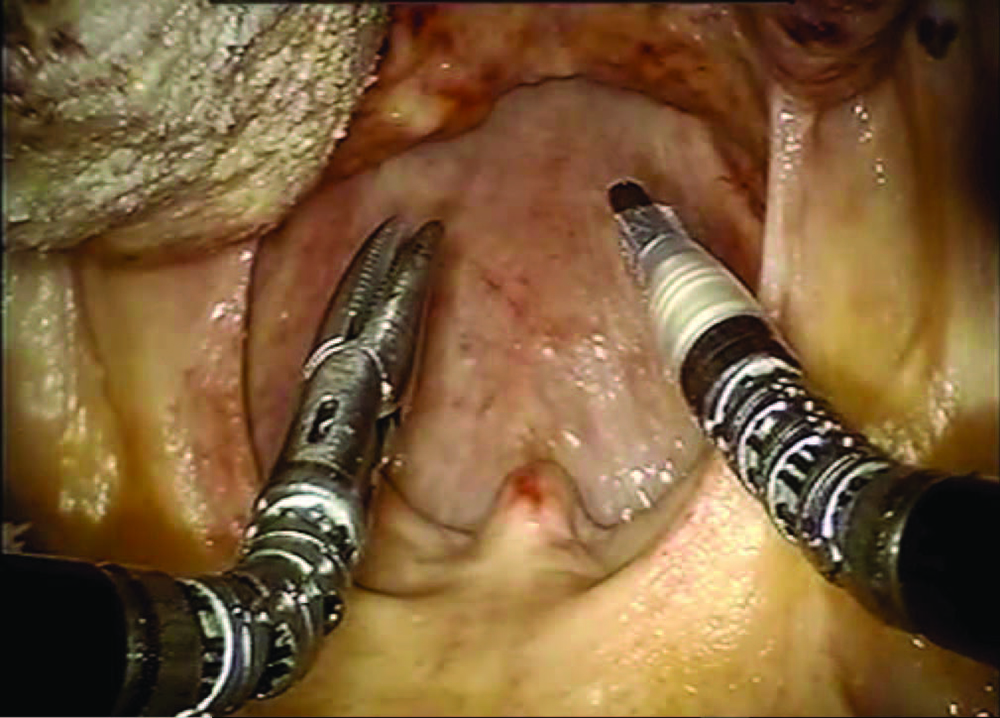
Figura 1. Visão da orofaringe pelo cirurgião, vista em uma tela do console. Dois braços do sistema robótico permitem múltiplos graus de movimento.
A seleção do caso cirúrgico é importante. Deve ser viável conseguir um acesso cirúrgico adequado e remover completamente o tumor. A abertura limitada da boca, mais comum em mulheres, pode impedir a exposição satisfatória. Os procedimentos mais comumente realizados são ressecções das amígdalas e da base da língua para cânceres orofaríngeos de estágio T1 e T2, junto com amigdalectomia ou mucosectomia lingual para remover a película da base da língua em busca de um câncer primário oculto de células escamosas do pescoço. Antes da TORS, o tratamento de pacientes com cânceres orofaríngeos geralmente implicava a clássica mandibulectomia, a traqueostomia, e a transferência de tecido livre, ou outras reconstruções, ou, alternativamente, a quimiorradioterapia. Essas intervenções todas têm morbidades bastante significativas. Em casos selecionados, a TORS agora oferece a opção de uma abordagem completamente transoral, mantendo, assim, a integridade da estrutura muscular da laringofaringe, que é importante para a função de deglutição. Permite-se que a maioria dos defeitos de tecido causados por cirurgia transoral sejam fechados com sucesso por meio de segunda intenção ao longo de várias semanas. Uma minoria dos defeitos requer alguma forma de reconstrução, como enxertos de pele, enxertos locais de tecido livre da mucosa, ou enxertos locais/regionais de tecido pediculado.
Com a abordagem cirúrgica primária, o uso de rádio e quimioterapia adjuvante pode ser reduzido ou eliminado por completo.3 Deve-se observar que as bases de evidências por trás da TORS ainda são limitadas a séries de casos, de um número comparativamente menor de centros que têm sido pioneiros no seu uso. Enquanto as pesquisas estão em andamento, não há evidências de alta qualidade de estudos controlados e randomizados que comparem desfechos oncológicos após a TORS àqueles da radioterapia e quimioterapia. Contudo, revisões sistemáticas sugerem que a TORS melhorou os resultados funcionais, com desfechos de melhor qualidade de vida relacionados à deglutição e alimentação oral em comparação a tratamentos não-cirúrgicos alternativos.5 Além do seu uso para câncer orofaríngeo comprovado, a TORS pode ser usada para realizar mucosectomia da base da língua para a identificação de tumores primários desconhecidos após falhas dos testes diagnósticos convencionais.6
Antes de uma ressecção de câncer orofaríngeo por TORS, os pacientes tipicamente se submetem a um caminho diagnóstico e terapêutico que incluem endoscopia nasal, exames de tomografia computadorizada (TC)/ressonância magnética, e pan-endoscopia para visualizar o campo cirúrgico e obter um diagnóstico histopatológico. Frequentemente, os pacientes precisam se submeter a uma dissecção limitada do pescoço, e a escolha de quando fazer este procedimento em relação a uma ressecção por TORS varia dependendo da instituição. Em alguns centros, como o nosso, os pacientes passam pela dissecção do pescoço algumas semanas antes do procedimento TORS. No momento da dissecção do pescoço, vários ramos (lingual, faríngeo ascendente e facial) da artéria carótida externa são suturados para ajudar a reduzir a chance de sangramento catastrófico durante o procedimento de ressecção de câncer orofaríngeo por TORS.
CONFIGURAÇÃO DA SALA DE CIRURGIA E DO ROBÔ
O requerimento de engatar o robô Da Vinci sobre a boca do paciente exige uma configuração particular da sala de cirurgia (Figura 2), que parece consistente em vários centros de TORS.7 Tanto o tempo de configuração quanto o de operação diminuem rapidamente com o aumento da experiência da equipe de operadores.8 É essencial ter um plano claro para a sala de cirurgia e configuração anestésica como uma diretriz local.
Após a indução de anestesia, a mesa de cirurgia é girada até ficar numa posição em que os pés do paciente estejam posicionados ao lado do aparelho de anestesia. Conforme seja apropriado para o local da cirurgia e a anatomia do paciente, um abridor cirúrgico do tipo Boyle-Davis ou Feyh-Kastenbauer será inserido. O robô é colocado em posição e os braços robóticos posicionados sobre o tórax do paciente. O endoscópio com câmera (linha do meio) e os instrumentos à direita e à esquerda são inseridos em suportes de trocarte e inseridos na boca. Eles são subsequentemente controlados pelo cirurgião a partir de um console em outro local da sala (Figura 3).
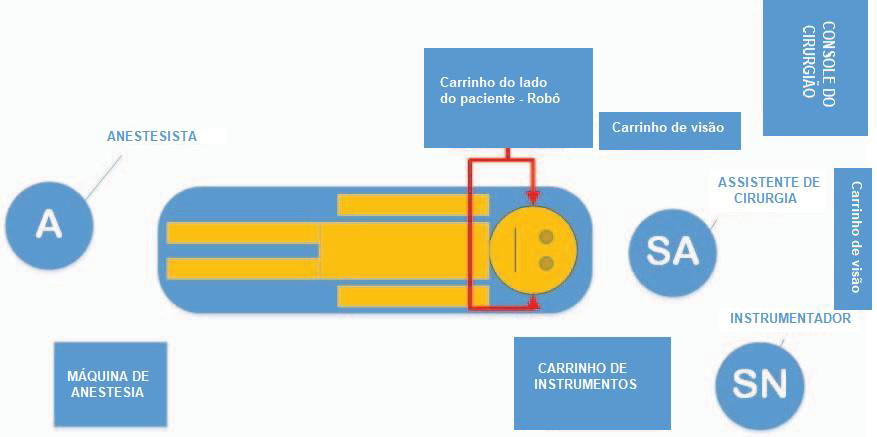
Figura 2. Exemplo de uma configuração de sala de cirurgia.
Quando o robô, a câmera e os instrumentos estão em posição, o acesso à cabeça, pescoço e tórax do paciente fica bastante restrito. Um procedimento de desengate de emergência precisa ser seguido caso seja necessário um acesso imediato. Tais situações podem incluir problemas com as vias aéreas, hemorragia cirúrgica que exija conversão para um procedimento “aberto”, e parada cardíaca. Recomenda-se que as instituições tenham um protocolo local de desengate de emergência que possa ser ensaiado, de forma que a equipe tenha clareza quanto às suas funções individuais.9
ANESTESIA PARA A TORS
Gestão da Via Aérea
Os pacientes que se submetem a ressecções por TORS correm o risco de ter dificuldades com as vias aéreas. Os tumores da orofaringe, cicatrizes cirúrgicas anteriores (incluindo de dissecção do pescoço), e radioterapia anterior podem interferir com a ventilação por máscara facial ou intubação. Além de realizar uma avaliação padrão da via aérea à beira do leito e consultar quadros anestésicos anteriores, o anestesista deve revisar os achados da endoscopia nasal e da TC com o cirurgião antes da cirurgia. A intubação de paciente consciente pode ser indicada.
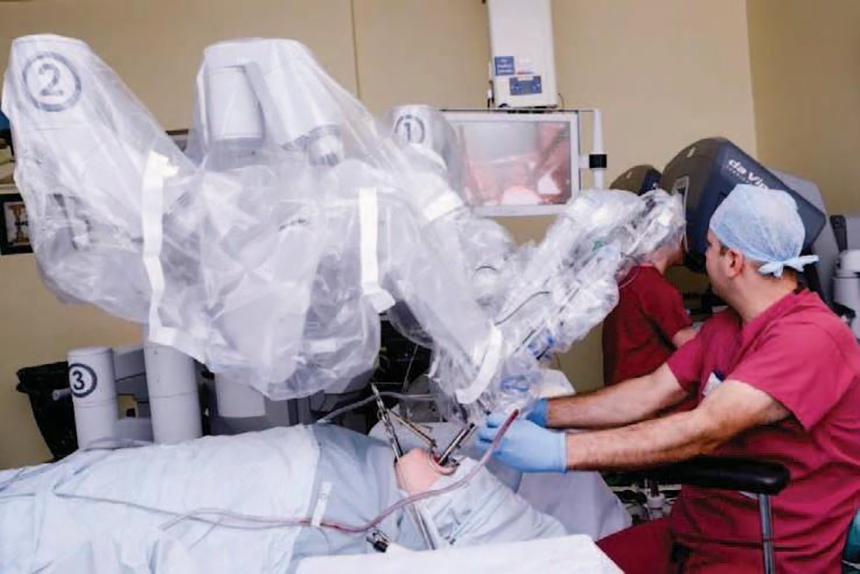
Figura 3. Robô e cirurgiões durante o procedimento. O cirurgião-chefe fica sentado em um console distante e opera em uma verdadeira visão endoscópica tridimensional do campo cirúrgico. O cirurgião assistente fica sentado em frente à cabeça do paciente, inserindo instrumentos intercambiáveis como eletrocautério, fórceps, e sucção em 2 braços de instrumentos.
No nosso centro, como preferido, usamos um tubo endotraqueal RAE nasal, contralateral ao tumor. Isso permite o acesso ideal para o robô com obstrução mínima do campo cirúrgico. O uso de vasoconstritores nasais antes da intubação nasal minimiza a lesão e sangramento da mucosa nasal. Eles podem ser auto-administrados pelo paciente como pré-medicação com spray nasal, seguida de spray anestésico vasoconstritor/local em indução. O acesso à via aérea fica extremamente restrito depois que o robô é engatado, de forma que o tubo endotraqueal deve bem preso, já que o deslocamento acidental intraoperatório pode ser desastroso. Alguns centros suturam o tubo ao rosto, se for usado um tubo oral.8 A colocação de material acolchoado entre o tubo endotraqueal e a testa evita danos por pressão.
Manutenção da Anestesia
A anestesia pode ser mantida com um anestésico volátil ou uma infusão de propofol. Qualquer que seja a escolha do agente hipnótico, a TORS pode ser muito estimulante, e várias estratégias foram descritas para minimizar a resposta simpática.10,11 Uma boa opção é usar uma infusão alvo-controlada de remifentanil com fentanil adicional. Em outros centros, o uso de outros opioides, como sufentanil, foi estabelecido. Muitos centros usam uma infusão de adjuvantes anestésicos como cetamina ou lidocaína. A hipertensão arterial resistente é incomum em pacientes cuja pressão arterial é bem controlada no pré-operatório, mas pode ser gerenciada com bloqueadores beta 6, alfa ou nitratos.11 O monitoramento arterial invasivo é indicado em pacientes com doença cardiovascular significativa que não tolerem frequência cardíaca ou pressão arterial extremas.
Pontos Práticos
- Os braços do paciente são difíceis de acessar no intraoperatório, e as extensões de linhas intravenosas são úteis.
- Há potencial dos braços do robô entrarem em contato com o rosto, e os olhos devem ser protegidos com fita ou óculos de proteção.
- Um bom relaxamento muscular é exigido para uma exposição cirúrgica ideal e para evitar tosse, pois isso pode causar o rompimento dos tecidos pelo robô. Um estimulador de nervo periférico deve ser usado para monitorar a função neuromuscular.
- Antibióticos intravenosos (de acordo com a política local) e esteroides devem ser administrados antes da incisão, e são continuados por 72 horas após a cirurgia. Em um estudo recente, uma terapia com dexametasona pós-operatória permite um avanço mais rápido na consistência de dieta e um menor tempo de permanência hospitalar.12
- Como para todo paciente com cirurgia prolongada, os passos comuns devem ser tomados para manter a normotermia e evitar lesões de pontos de pressão e trombose venosa profunda.
- Como em outros procedimentos transorais, há o risco de fogo na via aérea ao usar o cautério, se houver um vazamento de gás a partir do balonete do tubo endotraqueal. A concentração de oxigênio inspirado deve ser mantida abaixo de 0,3 para reduzir esse risco.
- Ao final da cirurgia, o cirurgião pode solicitar uma manobra de Valsalva para confirmar a hemostasia adequada. O paciente não deve estar hipotensivo durante este teste, a fim de evitar um resultado falso negativo. A via aérea deve ser inspecionada em busca de edemas. A expectativa seria que a maioria dos pacientes seriam extubados na sala de cirurgia imediatamente após a operação. Uma minoria, que tiverem dificuldades com vias aéreas, edema extenso ou outras comorbidades, podem requerer um período de intubação pós-operatória ou uma traqueostomia.
- Devido à natureza traumática do procedimento de TORS às estruturas orofaríngeas (músculos faríngeos, nervos e vasculatura), os pacientes estão sob um maior risco de aspiração pós-operatória. Um tubo nasogástrico é colocado em todos os nossos pacientes, e é particularmente importante se ocorrer uma comunicação oro-cervical durante o procedimento. Como é possível que a reinserção seja problemática, a sonda nasogástrica pode ser suturada ao septo nasal.
MANEJO PÓS-OPERATÓRIO
Analgesia Pós-Operatória
Um desafio na atenção pós-operatória é o controle da dor. Vale notar que há 2 locais de desconforto pós-operatório potencialmente significativos longe do local da cirurgia. O primeiro é a língua, que pode ficar retraída durante o procedimento. A língua também é o local mais comum de lesões não-intencionais causadas por retração ou movimentos de corte dos braços do robô. O septo nasal também pode ficar dolorido se um tubo nasogástrico tiver sido suturado a ele.
A analgesia multimodal baseada em opioides é uma estratégia chave, com fentanil intravenoso via analgesia controlada pelo paciente (ACP) ou infusões comumente usadas pelas primeiras 24 a 72 horas.10,11 Paracetamol comum e gabapentinoide são usados para reduzir a necessidade de opioides fortes, conforme a escada analgésica da Organização Mundial de Saúde. No nosso centro (onde não se realiza TORSA), a ACP com fentanil é iniciada na área de recuperação, e, adicionalmente, um emplastro transdérmico de fentanil é aplicado. Embora a TORS tenha a vantagem de rápida recuperação da deglutição na maioria dos pacientes, a via transdérmica é usada por oferecer a possibilidade de disponibilizar níveis consistentes de plasma de opioides fortes. É especialmente importante para aqueles indivíduos que não conseguem engolir por um período pós-operatório significativo. O emplastro é aplicado imediatamente após a cirurgia, pois não produz concentrações sanguíneas minimamente eficazes de fentanil até 12 horas depois, e o tempo até a concentração máxima é de aproximadamente 36 horas.13 O uso dessa combinação de opioides junto com outros analgésicos sedativos requer a cooperação entre a equipe cirúrgica, o pessoal de enfermaria, e a equipe de dor. O paciente deve ser monitorado de perto para a sedação e depressão respiratória. Quando da alta, os pacientes com emplastros de fentanil não podem ter outros opiáceos prescritos, e há rígidos critérios de exclusão para seu uso fora do hospital.
Esses critérios incluem pacientes com problemas do sistema respiratório, como apneia obstrutiva do sono, doença pulmonar obstrutiva crônica grave, ou aqueles com alto risco de desenvolver depressão respiratória, como idosos. No acompanhamento cirúrgico, a política padrão seria remover o emplastro.
Manejo de Complicações da TORS
A TORS está associada um risco de sangramento pós-operatório de 3% a 8%, que pode ser de natureza menor ou maior, e a maioria comumente ocorre por volta do 10 dia do pós-operatório.2,14 A maioria dos sangramentos são sangramentos venosos menores e de natureza autolimitante. Sangramentos maiores podem ser devidos à erosão dentro das artérias que foram grampeadas durante a cirurgia, ou devido à vasodilatação de vasos que estavam em espasmo durante a cirurgia e que, por isso, não foram controlados. Os pacientes frequentemente têm a deglutição alterada e mecanismos de proteção de vias aéreas comprometidos, e a morbidade e mortalidade decorrentes da hemorragia tendem a ser devidas à aspiração e asfixia, em oposição à exsanguinação.2 Em caso de sangramento, os pacientes devem colocar suas cabeças em uma posição com a boca pendente, para evitar a aspiração. Um gargarejo de peróxido de hidrogênio pode interromper pequenos sangramentos. Deve-se aplicar pressão externa ao pescoço, ipsilateralmente ao defeito faríngeo.² Todos os sangramentos significativos devem ser levados de volta à sala de cirurgia.
Embora o risco de sangramento primário na recuperação pareça semelhante ao que ocorre após uma amigdalectomia, os pacientes inicialmente vão para a recuperação em uma maca de transferência, de forma que possam retornar à sala de cirurgia imediatamente, caso necessário.
Podem ocorrer abcessos de pescoço se uma comunicação orocervical ocorrer e não for consertada. O risco de comunicação orocervical é mais alto em pacientes com dissecção concomitante do pescoço, embora a formação de fístula faringocutânea seja comparativamente rara (4%).15
Ingestão Oral
Sintomas de disfagia, disgeusia, refluxo nasofaríngeo ou insuficiência velofaríngea frequentemente ocorrem após a TORS.2 No nosso centro, a reintrodução de ingestão oral é feita estritamente com a supervisão de um fonoaudiólogo. A avaliação inicial acontece em momentos pós-operatórios variáveis, desde 48 horas após mucosectomias/amigdalectomias linguais, até 5 a 7 dias após ressecções da base da língua.
A meta é uma internação de 5 dias. Em alguns casos, isso pode ser prolongado, geralmente por causa do prejuízo à capacidade de deglutição.
O FUTURO DA TORS
As desvantagens da TORS incluem o alto custo-benefício do procedimento, e o alto custo de treinamento da equipe e manutenção do sistema robótico. Os benefícios da TORS incluem uma excisão precisa do tumor dentro de uma margem de tecido saudável e, portanto, um menor risco de cirurgias subsequentes. Uma menor perda de sangue, menor infeção do ferimento, e recuperação imediata da deglutição melhoram o período hospitalar após o procedimento, e a TORS tem mostrado ser economicamente viável. Um estudo também mostrou que pacientes que receberam TORS tiveram uma taxa menor de gastrostomia e traqueostomia em comparação a outros procedimentos cirúrgicos.3 A análise de resultados clínicos e de custo da TORS para casos de orofaringectomia lateral e ressecção da base da língua mostraram benefícios clínicos e de custo. O uso bem sucedido da TORS no tratamento cirúrgico de tumores orofaríngeos tem atraído o interesse para uso em outras cirurgias robóticas na cabeça e no pescoço que não estão atualmente usando a abordagem transoral, incluindo a cirurgia de tireoide, cirurgia da base do crânio, cirurgia pediátrica de vias aéreas, e reconstrução com enxerto de tecido livre. Estudos multicêntrisos são necessários em todas as áreas de cirurgia TORS para comprovar sua segurança e eficácia. Conforme a TORS se expande ou é introduzida, é importante que sejam produzidas diretrizes locais que apoiem altos padrões de cuidado perioperatório.
AGRADECIMENTOS
Os autores gostariam de agradecer ao Sr. Costa Repanos, cirurgião consultor em otorrinolaringologia, cabeça, pescoço e tireoide, pelas sugestões e comentários especializados sobre este artigo.
REFERÊNCIAS
- O’Malley BW Jr, Weinstein GS, Snyder W, et al. Transoral robotic surgery (TORS) for base of tongue neoplasms. Laryngoscope. 2006;116:1465-1472.
- Grillone GA, Scharukh J. Robotic Surgery of the Head and Neck. 1st ed. New York, NY: Springer; 2015.
- Hutcheson KA, Holsinger FC, Kupferman ME, et al. Functional outcomes after TORS for oropharyngeal cancer: a systematic review. Eur Arch Otorhinolaryngol. 2015;272:463-471.
- NHS England Specialised Services Clinical Reference Group for Complex Head and Neck Cancer. Clinical Commissioning Policy: Robotic Assisted Trans-oral surgery for Throat and Voice Box Cancers. https://www.england. nhs.uk/commissioning/wp-content/uploads/sites/12/2016/07/16008_FINAL.pdf. Accessed 10th July 2018.
- Yeh DH, Tam S, Fung K, et al. Transoral robotic surgery vs. radiotherapy for management of oropharyngeal squamous cell carcinoma: a systematic review of the literature. Eur J Surg Oncol. 2015;41:1603-1614.
- Winter SC, Ofo E, Meikle D, et al. Trans-oral robotic assisted tongue base mucosectomy for investigation of cancer of unknown primary in the head and neck region: the UK experience. Clin Otolaryngol. 2017;42:1247-1251.
- da Vincit Transoral Surgery Procedure Guide. PN 871671 Revision D 3/11. Intuitive Surgical, Inc. California, USA; 2011.
- Chi JJ, Mendel JE, Weinstein GS, et al. Anaesthetic considerations for transoral robotic surgery. Anaesthesiol Clin 2010;28:411-422.
- O’Sullivan OE, O’Sullivan S, Hewitt M, et al. Da Vinci robot emergency undocking protocol. J Robot Surg. 2016;10:251- 253.
- Loh KW, Teo LM. Anaesthesia for DaVinci assisted intraoral and tongue base operations. Trends Anaesth Crit Care. 2013;3:342-345.
- Hariharan U, Shah SB, Bhargava AK. Anesthesia for trans-oral robotic surgery: practical considerations. EC Anaesth. 2016;2.5:212-216.
- Clayburgh D, Stott W, Bolognone R, et al. A randomized controlled trial of corticosteroids for pain after transoral robotic surgery. Laryngoscope. 2017;127:2558-2564.
- Muijsers RBR, Wagstaff AJ. Transdermal fentanyl: an updated review of its pharmacological properties and therapeutic efficacy in chronic cancer pain control. Drugs. 2001;61:2289-2307.
- Pollei TR, Hinni ML, Moore EJ, et al. Analysis of postoperative bleeding and risk facTORS in transoral surgery of the oropharynx. JAMA Otolaryngol Head Neck Surg. 2013;139:1212-1218.
- Moore EJ, Olsen KD, Martin EJ. Concurrent neck dissection and transoral robotic surgery. Laryngoscope. 2011;121:541- 544.



