Paediatric Anaesthesia
PONTOS CHAVE
- Delírio ao despertar é um estado transitório de dissociação da consciência que ocorre após interrupção de anestesia. Caracteriza-se por irritação importante e agitação psicomotora.
- A incidência comumente relatada de delírio ao despertar em pacientes pediátricos é cerca de 10% a 30%.
- Os fatores de risco associados a delírio ao despertar são idade, comportamentos pré-existentes, tipo de cirurgia e uso de anestesia inalatória.
- Dor no pós-operatório pode confundir a identificação de delírio ao despertar.
- Os pacientes que apresentam delírio ao despertar têm maior risco de desenvolver comportamentos mal adaptativos pós-operatórios.
- Intervenções para diminuir delírio ao despertar incluem a escolha de técnicas anestésicas, medicamentos e intervenções não farmacológicas. É fundamental que o anestesista reveja e selecione a estratégia mais apropriada para cada paciente individual.
INTRODUÇÃO
Delírio ao Despertar (DD) foi descrito pela primeira vez na literatura no início da década de 1960. Embora frequentemente chamado agitação ao despertar, é definido como um estado transitório de dissociação da consciência após a interrupção da anestesia. As características do DD incluem irritabilidade, choro inconsolável, angústia e incapacidade de cooperar.1 Na prática, pode ser desafiador identificar com precisão pacientes que estão em risco de desenvolver DD, bem como prevenir e tratar DD. Este tutorial analisa o que sabemos atualmente sobre DD, quem está em risco de desenvolver DD e as intervenções farmacológicas e não farmacológicas que podem ser usadas para tratá-lo.
INCIDÊNCIA
A incidência de DD tem sido relatada variando de 2% a 80%. O consenso mais comum da literatura é incidência de 10% a 30% de todas as crianças na sala de Recuperação Pós-Anestésica (RPA). Essa ampla variedade resulta de diferenças no desenho, metodologia e interpretação dos estudos.1 A incidência de DD é maior em pediatria do que a relatada na população adulta (5.3%).2
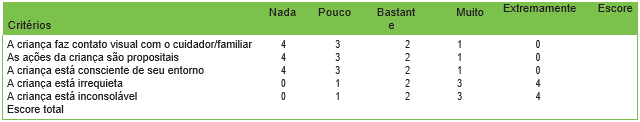
Tabela 1. Escala Pediatric Anaesthesia Emergence Delirium (PAED). A escala PAED consiste em 5 critérios com uma escala de 5 pontos. Os escores de cada critério são somados para atingir um escore total. O escore máximo é 20. Escore ≥ 10 tem sensibilidade de 64% e especificidade 86% para o diagnóstico de DD. Um escore >12 tem 100% de sensibilidade e 94.5% de especificidade para o diagnóstico de DD.18
CARACTERÍSTICAS
Os sinais e sintomas de DD incluem choro inconsolável, movimentos descontrolados e falta de cooperação. Esses podem levar a efeitos negativos de curto e longo prazo sobre a criança, os pais e os cuidadores diretos na RPA. Por exemplo, crianças com DD podem romper pontos cirúrgicos em função de movimento excessivo; podem deslocar acessos venosos (IV) e drenos ou tubos. Essas crianças representam risco de machucar não apenas a si próprias, mas também à equipe da RPA. Além disso, o cuidado dessas crianças com frequência demanda pessoal extra de enfermagem, o que pode comprometer a capacidade de pessoal na RPA. A satisfação dos pais está se tornando um parâmetro importante para a assistência anestésica. Pais de crianças com DD frequentemente expressam preocupação, ansiedade e insatisfação.1 A longo prazo, as crianças com DD têm 1,4 vezes mais chances de ter um novo episódio de alterações comportamentais mal adaptativas (transtorno do sono, ansiedade de separação, transtorno alimentar) por até 2 semanas após a cirurgia.2
O desafio para os cuidadores é como identificar melhor o DD por meio de um sistema de classificação objetivo. As manifestações de DD podem se sobrepor às expressas por crianças com dor, e até o momento, não há uma escala de classificação que possa discriminar de forma confiável entre essas duas situações. Várias escalas foram propostas, e a escala de Delírio ao Acordar de Anestesia Pediátrica (PAED) é considerada o padrão-ouro (Tabela 1). Foi desenvolvida em 2004 e validada para identificar DD em crianças com mais de 2 anos.3
FATORES DE RISCO
O reconhecimento dos fatores de risco para DD permite ao anestesista antecipar, prevenir e manejar o DD. Estes podem ser categorizados em 3 categorias: fatores de risco do paciente, tipo de cirurgia e técnica anestésica (Figura 1).

Figura 1. Categorias de fatores de risco para delírio ao despertar.
Fatores de Risco do Paciente
Considera-se ansiedade pré-existente ou comportamentos mal adaptativos como o maior fator de risco para o desenvolvimento de DD, incluindo comportamento agitado e não cooperativo; exibições exageradas de raiva (acessos de raiva); e pouca capacidade de adaptação.4 O grau de ansiedade pré-operatória do paciente também se correlaciona com DD. Além disso, um alto nível de ansiedade dos pais contribui para maior nível de ansiedade pré-operatória na criança.3 Pacientes de 2 a 7 anos têm maior risco de DD quando comparados com maiores de 7 anos.
Fatores de Risco Cirúrgicos
Alguns tipos de procedimentos cirúrgicos estão positivamente associados a aumento de risco de DD. Especificamente, cirurgias de ouvidos, nariz e garganta têm a maior incidência de DD (42.2%), seguidas por procedimentos abdominais, ortopédicos e urológicos.4
Fatores de Risco Anestésicos
O uso de anestésicos inalatórios tem sido fortemente associado com a apresentação de DD. Isoflurano, halotano, sevoflurano e desflurano foram todos associados a DD. Embora tenha sido constatado que o uso de sevoflurano tem a maior incidência de DD, isso pode ser devido ao fato de que a maioria dos estudos foi realizada utilizando sevoflurano. Emergência súbita também foi identificada como outro possível fator contribuinte.4 O despertar repentino em um ambiente desconhecido com estranhos pode piorar o medo pré-existente dos pacientes. Além disso, as crianças pré-escolares têm imaturidade psicológica e mais dificuldade de lidar com um retorno rápido da consciência em um ambiente estranho.5
Dor pós-operatória pode confundir a identificação de DD. Muitas vezes é difícil, especialmente na criança não verbal, diferenciar entre dor e delírio. Se a dor for descartada, o diagnóstico de DD, principalmente com escala PAED positiva, é mais provável.6 O desafio é que os descritores da escala PAED possam ser encontrados em crianças com dor, bem como naquelas com DD (e sem dor). Um estudo recente analisou esses descritores para determinar quais eram os mais prováveis. Por exemplo, não fazer contato visual e não ter consciência do entorno é mais provavelmente consistente com DD. Expressão facial anormal, não conseguir ser consolado e choro enquanto o paciente está fazendo contato visual e está consciente de seu entorno é mais provável de dor. Para um caso em que DD e dor não possam ser discriminados, a dor deve ser considerada e tratada primeiro, seguida de uma reavaliação para DD.6
PREVENÇÃO E TRATAMENTO
Agentes Inalatórios versus Anestesia IV Total
Como mencionado anteriormente, o uso de agentes inalatórios está associado a risco aumentado de desenvolvimento de DD. Por outro lado, anestesia geral intravenosa está associada a menor risco de DD.3
Propofol é o agente mais usado para anestesia intravenosa total. A eficácia da administração de propofol na prevenção de DD varia dependendo do momento e da dose administrada. Uma infusão somente de propofol como anestésico de manutenção tem sido eficaz na redução da incidência de DD. No entanto, nem sempre é possível atingir uma profundidade adequada de anestesia, dependendo da natureza do procedimento. O papel do propofol em bolo dado como profilaxia para DD não é bem estabelecido. Existem dados para apoiar que 3 mg/kg de propofol ao longo de 3 minutos no final da anestesia com sevoflurano pode diminuir a incidência de DD.7
Medicamentos
Agonistas dos Receptores Alfa 2
Agonistas alfa 2 tal como clonidina e dexmedetomidina têm se mostrado eficazes na profilaxia pois diminuem a frequência e gravidade do DD. Embora ambos sejam agonistas dos receptores alfa 2, dexmedetomidina tem maior afinidade pelos adrenoreceptores alfa 2 (a2/a1=1620/1) do que clonidina (a2/a1=220/1) e pode ser clinicamente mais eficaz do que clonidina para diminuir a incidência de DD.8
Em um estudo randomizado, placebo controlado, duplo-cego, dexmedetomidina 1 e 2 µg kg—1 intranasal foi administrada no pré-operatório, tendo reduzido a incidência de DD.9 Além disso, dexmedetomidina 2 µg kg—1 em bolo IV seguido de 0,7 µg kg—1 h—1 no transoperatório se mostrou mais eficaz na diminuição do DD do que uma única dose de fentanil IV 1 µg kg—1, em pacientes submetidos a tonsilectomia e adenoidectomia.10 Quando administrado 5 minutos antes de extubação, dexmedetomidina 0,3 µg kg—1 foi mais eficaz que propofol 1mg kg —1 em diminuir a incidência de DD após adenotonsilectomia.11
Além de diminuir DD, existem vários benefícios associados ao uso de dexmedetomidina. A farmacocinética e a farmacodinâmica da dexmedetomidina a tornam aceitável para a administração IV e intramuscular.
A dexmedetomidina não causa depressão respiratória11 e possui propriedades sinérgicas para analgesia, bem como diminui a necessidade de narcóticos, anestésicos inalatórios e propofol. Relatórios preliminares sugerem que pode diminuir a incidência de náuseas e vômitos pós-operatórios quando administrada como uma infusão contínua. Por fim, seu metabolismo é minimamente afetado por idade ou comorbidades.
Narcóticos
Vários narcóticos, incluindo fentanil, remifentanil, sufentanil e alfentanil foram estudados como medidas profiláticas para prevenir DD. A eficácia dos narcóticos na prevenção de DD não é clara. Estudos individuais até o momento tiveram resultados mistos.
Fentanil 2 a 2,5 µg kg—1 intranasal ou 1 a 2 µg kg—1 IV reduz a duração e a gravidade do DD, sem afetar o tempo para atender aos critérios de alta. No entanto, fentanil aumenta significativamente náuseas e vômitos no pós-operatório,12 por isso seu uso deve ser cuidadosamente avaliado. Até o momento, não há dados claros em apoio a qualquer narcótico como profilático para DD. Deve-se usar cautela na avaliação dos estudos publicados, pois os narcóticos podem diminuir as manifestações de dor e confundir o escore PAED em crianças que estão com dor, mas que não têm DD.
Midazolam
Midazolam é a pré-medicação oral mais comumente prescrita no pré-operatório. Seus benefícios incluem manejo da ansiedade pré-operatória, amnésia, início relativamente rápido e curta duração de ação. Embora na maioria das crianças midazolam controle a ansiedade, até 29% podem apresentar uma resposta de agitação paradoxal.13
Midazolam (quer seja dado antes da indução ou no final da cirurgia) foi amplamente estudado para a prevenção de DD. Até o momento, não há suporte para midazolam como profilático, independente do momento da administração. Uma meta-análise foi incapaz de dar sustentação a seu benefício.3
Apesar dos dados conflitantes, midazolam ainda deve ser considerado em pacientes de risco, uma vez que pode proporcionar controle da ansiedade e, em alguns estudos, diminuição de comportamentos mal adaptativos por até 1 semana.14
Gabapentina
Gabapentina pode ser um profilático eficaz em crianças, embora não tenha demonstrado eficácia em adultos.15 Em crianças submetidas a adenotonsilectomia, gabapentina diminui a gravidade do DD.3
Melatonina
Doses de melatonina oral até 0.4 mg/kg (máximo 20 mg) reduzem DD em crianças (idade 3 a 7 anos).16
Ketamina
A premedicação com ketamina mostra-se mais eficaz do que o midazolam na redução da incidência de DD durante o período inicial da recuperação (10 minutos, 20 minutos) após anestesia com sevoflurano em crianças.17 Além disso, ketamina (1 mg kg—1 IV em bolo seguido de infusão de 1 mg kg—1 h—1) é tão eficaz quanto dexmedetomidina (1 µg kg—1 IV seguida por infusão de 1 µg kg—1 h—1) na diminuição da incidência de DD.18 No entanto, do ponto de vista prático, ketamina talvez não seja tão adequada como profilático para DD, pois produz efeitos colaterais indesejados que não compensam sua eficácia (alucinações, confusão, náusea/vômito). De 5% a 30% dos pacientes têm pesadelos e alucinações com altas doses.18
Anestesia Regional
Até o momento, anestesia regional não foi estudada profundamente em relação a DD. Seu valor para profilaxia de DD não foi demonstrado.3
Intervenções Não Farmacológicas
A acupuntura pode ser uma técnica importante na diminuição do DD. Um estudo controlado duplo-cego randomizado no Japão mostrou diminuição em DD em pacientes pediátricos que receberam estimulação elétrica no ponto de acupuntura coração 7 (HT7) com um estimulador de nervo periférico.19
A ansiedade pré-operatória é reconhecida como fator de risco para ED. Técnicas não farmacológicas, comportamentais e de distração para minimizar a ansiedade pré-operatória estão sendo estudadas. Para algumas crianças, na indução, a distração por vídeo tem se mostrado um ansiolítico tão eficaz quanto a presença dos pais. Kim et al20 descobriram que a distração por vídeo, a presença dos pais ou uma combinação de ambos tiveram um efeito semelhante no DD. Além da distração por vídeo, foi estudado o efeito de transportar num carro de brinquedo sobre ansiedade pré-operatória. O transporte em carro de brinquedo foi eficaz na redução da ansiedade pré-operatória em comparação com o midazolam oral.21
Para entender melhor a eficácia dessas intervenções não farmacológicas precisamos estudos em larga escala para determinar sua capacidade de reduzir DD.
RESUMO
DD tem sido estudado há mais de 60 anos como um estado transitório de dissociação de consciência após anestesia caracterizado por irritabilidade e agitação psicomotora. É visto comumente em crianças mais novas, de 2 a 6 anos. Embora autolimitado, pode ter consequências sérias para algumas crianças. Idade do paciente, disposição (personalidade mal adaptativa), grau de ansiedade pré-operatória, procedimento cirúrgico e técnica anestésica foram identificados como desempenhando papéis importantes no DD. O desafio é a sobreposição dos comportamentos dos pacientes na RPA quando com dor, ou com DD. Até o momento, os tratamentos profiláticos mais eficazes são a dexmedetomidina, os esforços para estabelecer uma boa relação com o paciente e usar técnicas não farmacológicas para diminuir a ansiedade. Outras intervenções não farmacológicas como acupuntura e distração por vídeo, foram estudadas no passado, mas mais pesquisas são necessárias para entender melhor seus efeitos. Entender os fatores de risco e as opções de tratamento é fundamental para o manejo de DD.
REFERÊNCIAS
- Reduque LL, Verghese Paediatric emergence delirium. Contin Educ Anaesth Crit Care Pain. 2013;13(2):39-41.
- Kain ZN, Caldwell-Andrews AA, Maranets I, et al. Preoperative anxiety and emergence delirium and postoperative maladaptive Anesth Analg. 2004;99(6):1648-1654.
- Mason K. Paediatric emergence delirium: a comprehensive review and interpretation of the literature. Br J Anaesth. 2017;118(3):335-343.
- Voepel-Lewis T, Malviya S, Tait AR. A prospective cohort study of emergence agitation in the pediatric postanesthesia care Anesth Analg. 2003;96(6):1625-1630.
- Aono J, Ueda W, Mamiya K, Takimoto E, Manabe M. Greater incidence of delirium during recovery from sevoflurane anesthesia in preschool Anesthesiology. 1997;87(6):1298-1300.
- Somaini M, Engelhardt T, Fumagalli R, Ingelmo P. Emergence delirium or pain after anaesthesia—how to distinguish between the two in young children: a retrospective analysis of observational Br Jo Anaesth. 2016;116(3):377-383.
- Costi D, Ellwood J, Wallace A, Ahmed S, Waring L, Cyna Transition to propofol after sevoflurane anesthesia to prevent emergence agitation: a randomized controlled trial. Pediatr Anesth. 2015;25(5):517-523.
- Das A, Kundu R, Mukherjee A, Basunia S, Bhattacharyya R, Chattopadhyay S. Emergence agitation prevention in paediatric ambulatory surgery: a comparison between intranasal dexmedetomidine and clonidine. J Res Pharm Pract. 2015;4(1):24.
- Yao Y, Qian B, Lin Y, Wu W, Ye H, Chen Y. Intranasal dexmedetomidine premedication reduces minimum alveolar concentration of sevoflurane for laryngeal mask airway insertion and emergence delirium in children: a prospective, randomized, double-blind, placebo-controlled Pediatr Anesth. 2014;25(5):492-498.
- Patel A, Davidson M, Tran MCJ, et Dexmedetomidine infusion for analgesia and prevention of emergence agitation in children with obstructive sleep apnea syndrome undergoing tonsillectomy and adenoidectomy. Anesth Analg. 2010;111:1004-1010.
- Abdellatif A, Ali M. Prevention of sevoflurane related emergence agitation in children undergoing adenotonsillectomy: a comparison of dexmedetomidine and Saudi J Anaesth. 2013;7(3):296-300. doi: 10.4103/1658-354X.115363.
- Shi F, Xiao Y, Xiong W, Zhou Q, Yang P, Huang X. Effects of fentanyl on emergence agitation in children under sevoflurane anesthesia: meta-analysis of randomized controlled trials. PLOS ONE. 2015;10(8):e0135244. doi: 10.1371/ pone.0135244.
- Shin YH, Kim MH, Lee JJ, et The effect of midazolam dose and age on the paradoxical midazolam reaction in Korean pediatric patients. Korean J Anesthesiol. 2013;65(1):9-13.
- Kain ZN, Mayes LC, Wang S-M, Hofstadter MB. Postoperative behavioral outcomes in children: effects of sedative Surv Anesthesiol. 1999;43(5):282.
- Leung JM, Sands LP, Chen N, et al. Perioperative gabapentin does not reduce postoperative delirium in older surgical Anesthesiology. 2017;127(4):633-644.
- Kain ZN, Maclaren JE, Herrmann L, et Preoperative melatonin and its effects on induction and emergence in children undergoing anesthesia and surgery. Anesthesiology. 2009;111(1):44-49.
- Kim KM, Lee KH, Kim YH, Ko MJ, Jung J, Kang E. Comparison of effects of intravenous midazolam and ketamine on emergence agitation in children: randomized controlled J Int Med Res. 2016;44(2):258-266.
- Chen J, Jia J, Liu T, Qin M, Li Comparison of the effects of dexmedetomidine, ketamine, and placebo on emergence agitation after strabismus surgery in children. Can J Anesth. 2013;60(4):385-392.
- Hijikata T, Mihara T, Nakamura N, Miwa T, Ka K, Goto Electrical stimulation of the heart 7 acupuncture site for preventing emergence agitation in children. Eur J Anaesthesiol. 2016;33(7):535-542.
- Kim H, Jung SM, Yu H, Park S-J. Video distraction and parental presence for the management of preoperative anxiety and postoperative behavioral disturbance in Anesth Analg. 2015;121(3):778-784.
- Liu P, Sun Y, Wu C, et The effectiveness of transport in a toy car for reducing preoperative anxiety in preschool children: a randomised controlled prospective trial. Br J Anaesth. 2018;121(2):438-444.
WFSA Disclaimer
The material and content provided has been set out in good faith for information and educational purposes only and is not intended as a substitute for the active involvement and judgement of appropriate professional medical and technical personnel. Neither we, the authors, nor other parties involved in its production make any representations or give any warranties with respect to its accuracy, applicability, or com- pleteness nor is any responsibility accepted for any adverse effects arising as a result of your reading or viewing this material and content. Any and all liability directly or indirectly arising from the use of this material and content is disclaimed without reservation.



