Basic Sciences
QUESTÕES-CHAVE
Este tutorial revisa a farmacologia básica dos anestésicos endovenosos (EV) mais comuns. Ao final do tutorial, você deve ser capaz de escolher a droga mais apropriada para usar nas situações abaixo e justificá-las:
- Um paciente com obstrução intestinal que necessita de laparotomia de emergência.
- Um paciente com história de câncer de laringe, apresentando estridor evidente e sinais de insuficiência respiratória, necessita de traqueostomia.
- Um paciente que necessita de troca de curativo para queimadura
- Um paciente com história de insuficiência cardíaca que necessita de anestesia geral
- Um paciente desidratado, hipovolêmico, que necessita de anestesia geral de emergência
- Um paciente com porfiria que é admitido para herniorrafia inguinal e necessita de anestesia geral
- Um paciente que necessita de sedação na Unidade de Terapia Intensiva
- Anestesia no âmbito pré-hospitalar
O QUE SÃO FÁRMACOS PARA INDUÇÃO ANESTÉSICA?
São fármacos que, quando administrados por via endovenosa em dose adequada, causam rápida perda de consciência. Isso é frequentemente descrito como “um tempo braço-cérebro”, que significa o tempo necessário para que o fármaco chegue do local de injeção (geralmente o braço) até o cérebro, seu sítio de ação.
São utilizados:
- Para induzir a anestesia, anteriormente à administração de drogas para manutenção da anestesia.
- Como droga única para procedimentos rápidos.
- Para a manutenção da anestesia para procedimentos mais longos por meio de infusão endovenosa contínua.
- Para promover sedação.
O conceito de anestesia endovenosa originou-se em 1932, quando Wesse e Schrapff publicaram seu relato sobre o uso do hexobarbital, a primeira droga endovenosa de ação rápida. Dois anos depois, em 1934, o tiopental sódico foi introduzido à prática clínica por Waters e Lundy, e ainda é muito utilizado atualmente. Alguns outros fármacos têm entrado e saído do uso habitual. As drogas mais comuns utilizadas no momento podem ser classificadas de acordo com sua estrutura química, e incluem:
- Barbitúricos
- Fenóis
- Imidazóis
- Fenciclidinas
- Benzodiazepínicos
Os exemplos mais utilizados de cada classe serão discutidos abaixo.
DA INDUÇÃO À RECUPERAÇÃO DA CONSCIÊNCIA: O QUE ACONTECE COM UM BOLUS DE DROGA EV?
Ao entrar na corrente sanguínea, uma porcentagem da droga se liga a proteínas plasmáticas e o restante permanece não-ligado ou “livre”. O grau de ligação proteica depende das características físicas do fármaco em questão – como por exemplo lipossolubilidade e grau de ionização. A droga segue pelo sangue venoso até o lado direito do coração, através da circulação pulmonar, e através do lado esquerdo do coração até a circulação sistêmica. A maior parte do débito cardíaco (70%) passa pelo cérebro, fígado e rins (frequentemente denominados “órgãos ricamente vascularizados”); portanto uma grande proporção do bolus inicial é entregue à circulação cerebral. O fármaco então passa, através de um gradiente de concentração, do sangue para o cérebro. A taxa dessa transferência depende de diversos fatores:
- A concentração arterial de droga livre
- A lipossolubilidade da droga
- O grau de ionização.
Moléculas livres, lipossolúveis e não-ionizadas atravessam a barreira hemato-encefálica mais rapidamente.
A droga exerce seus efeitos uma vez que tenha penetrado o sistema nervoso central (SNC). Assim como a maioria dos fármacos anestésicos, o mecanismo exato de ação dos anestésicos endovenosos não é completamente conhecido. Estima-se que cada droga aja em um receptor específico – GABA-A, NMDA e receptores colinérgicos têm sido estudados como potenciais sítios de ação.
Após a distribuição de moléculas não-ionizadas para o CNS e outros tecidos ricamente vascularizados, a droga começa a se difundir para outros tecidos que não têm suprimento sanguíneo tão pronunciado. Essa captação secundária da droga, principalmente pela musculatura esquelética, resulta em diminuição da sua concentração plasmática, permitindo que a droga se difunda para fora do SNC como resultado da reversão do gradiente de concentração. É essa redistribuição inicial do fármaco para outros tecidos que causa a recuperação rápida da consciência vista após dose única de uma droga de indução. Metabolismo e clearance plasmático têm impacto consideravelmente menor após um bolus único, porém são mais importantes em se tratando de infusões e doses repetidas de uma droga.
O tecido adiposo contribui pouco para a redistribuição inicial de droga livre que ocorre após um bolus, uma vez que é um tecido pobremente vascularizado, como pode ser observado no diagrama abaixo. Contudo, após doses repetidas ou infusões, o equilíbrio com o tecido adiposo forma um reservatório de droga, frequentemente resultando em atraso na recuperação da consciência.
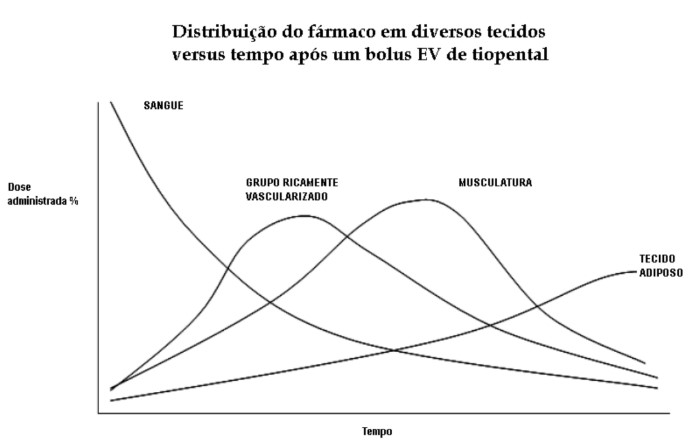
Figura 1. Distribuição do fármaco em diversos tecidos versus tempo após um bolus endovenoso de tiopental
O QUE MUDA EM ESTADOS DE DÉBITO CARDÍACO DIMINUÍDO?
Em circunstâncias com débito cardíaco diminuído (choque, idade avançada), o corpo compensa desviando uma maior proporção do débito cardíaco para a circulação cerebral, haja vista que preservação do fluxo sanguíneo cerebral é de suma importância nessas situações. Dessa maneira, maior proporção de uma determinada droga administrada atingirá a circulação cerebral. Como resultado, a dose de indução deve sempre ser reduzida. Ademais, uma vez que o débito cardíaco global está diminuído, o tempo necessário para que uma droga atinja o SNC e exerça seus efeitos é prolongado. A titulação lenta de uma dose reduzida da droga é essencial para uma indução segura nesses pacientes.
AS PROPRIEDADES DE UM ANESTÉSICO ENDOVENOSO IDEAL
Diversas propriedades, tanto físicas quanto farmacológicas (farmacocinéticas e farmacodinâmicas) são desejáveis quando da criação de um anestésico endovenoso ideal. Essas propriedades serão elencadas e, em seguida, comparadas com as drogas mais comumente utilizadas.
Propriedades Físicas
- Hidrossolúvel e estável em solução
- Estável à exposição à luz
- Passível de longo tempo de armazenamento
- Ausência de dor à injeção
- Dolorosa quando injetada em uma artéria
- Não-irritante quando injetada no subcutâneo
- Baixa incidência de tromboflebite
- Baixo custo
Propriedades Farmacocinéticas
- Rápido início de ação em um tempo braço-cérebro
- Rápida redistribuição para tecidos ricamente vascularizados
- Clearance e metabolismo rápidos
- Ausência de metabólitos ativos
Propriedades Farmacodinâmicas
- Alto índice terapêutico (índice de dose tóxica/dose mínima efetiva)
- Efeitos mínimos sobre os sistemas cardiovascular e respiratório
- Ausência de liberação de histamina e reações de hipersensibilidade
- Ausência de efeitos emetizantes
- Ausência de movimentos involuntários
- Ausência de pesadelos à emergência da anestesia
- Ausência de efeito ressaca
- Ausência de supressão adrenocortical
- Segurança para uso na porfiria
PROPRIEDADES DE ANESTÉSICOS ENDOVENOSOS ESPECÍFICOS
Tiopental Sódico
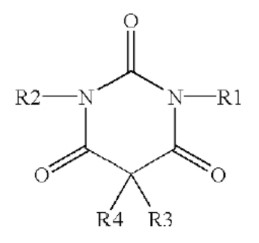
O tiopental, também conhecido como tionembutal e penthotal, é um barbitúrico, apresentado como um pó amarelo-claro higroscópico (isto é, que atrai umidade da atmosfera). Ampolas contêm geralmente 500mg de tiopental sódico com carbonato de sódio a 6% em uma atmosfera inerte de nitrogênio. Reconstituído com 20 ml de água destilada, resulta em uma solução a 2.5% (25mg/ml) com um pH de 10,8. A solução alcalina é bacteriostática e seu armazenamento é seguro até 48 horas. A estrutura molecular do tiopental é baseada no anel barbitúrico – como se pode observar acima. Um átomo sulfúrico na posição do carbono R2 confere sua curta duração de ação.
Uma dose de 4-5mg/kg de tiopental promove instalação suave de hipnose com critérios de avaliação definitivos dentro de 30 segundos da injeção endovenosa. A recuperação da consciência após dose única ocorre rapidamente devido à redistribuição da droga. A incidência de agitação, náusea e vômitos é baixa.
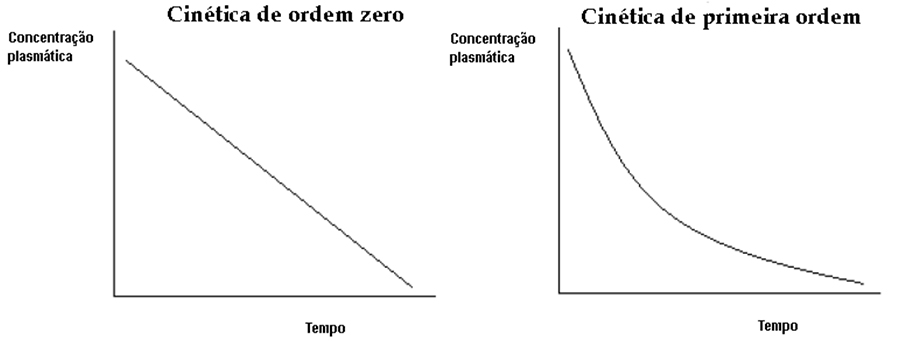
A taxa de ligação proteica do tiopental no plasma é de 65-85%. Seu metabolismo é lento e ocorre no fígado, e a excreção de seus metabólitos ocorre primariamente na urina. Após doses repetidas ou infusão contínua de tiopental, o metabolismo segue a cinética de ordem zero, também conhecida como cinética de saturação, o que significa que uma quantidade constante de droga é eliminada por unidade de tempo, independentemente da concentração plasmática. Algumas drogas são metabolizadas por cinética de primeira ordem; uma fração constante da droga é eliminada por unidade de tempo, ou seja, depende da concentração plasmática. Cinética de ordem zero ocorre quando as vias metabólicas se saturam, levando à acumulação de droga ativa e retardo na recuperação.
O tiopental deprime diretamente a contratilidade miocárdica, reduzindo o débito cardíaco e pressão arterial. Pode haver taquicardia reflexa. Ocorre também diminuição do tônus venoso, causando represamento de sangue nas veias periféricas, o que aumenta a magnitude da hipotensão, particularmente em pacientes hipovolêmicos.
Depressão ventilatória é comum e um período de apnéia ocorre habitualmente após uma dose em bolus. Reflexos de via aérea são bem preservados em comparação com o propofol, de modo que é uma droga inadequada para inserção de máscara laríngea, que pode resultar em tosse e laringoespasmo. Liberação de histamina pode ocorrer e precipitar broncoespasmo.
O tiopental reduz o fluxo sanguíneo cerebral, a taxa metabólica cerebral e a demanda de oxigênio. Tem também potentes propriedades anticonvulsivantes. Após traumatismo crânio-encefálico, tiopental em infusão objetivando um “coma barbitúrico” reduz a pressão intracraniana e pode melhorar o prognóstico neurológico. Contudo, isso é associado a acumulação significativa, que resulta em efeito prolongado com múltiplas complicações.
As porfirias são um grupo de doenças caracterizadas pela superprodução e excreção de porfirinas (compostos intermediários produzidos durante a síntese de hemoproteínas). Episódios agudos podem ser precipitados por fármacos, estresse, infecção, álcool, gestação e jejum prolongado. O tiopental pode precipitar porfiria em pacientes suscetíveis através da indução de enzimas hepáticas, e portanto deve ser evitado.
Propofol (2,6 di-isopropilfenol)
O propofol é geralmente apresentado a 1 ou 2% como emulsão aquosa (gotículas de lipídio em suspensão, por isso a coloração branca) contendo óleo de soja, lecitina de ovo e glicerol. É isotônico em relação ao plasma e tem um pH de 7,0 a 8,5. Pode causar dor à injeção em veias de pequeno calibre.
Trata-se de um anestésico geral de curta duração, com latência de aproximadamente 30 segundos. A recuperação da anestesia é habitualmente rápida. Indução suave de anestesia ocorre normalmente após uma dose de 2-2,5mg/kg. O propofol deve ser titulado conforme a resposta do paciente até que sinais clínicos demonstrem o início da anestesia. O melhor parâmetro de avaliação é a perda de contato verbal com o paciente.
Após um bolus endovenoso, há equilíbrio rápido entre o plasma e o tecido ricamente vascularizado do cérebro, conforme descrito anteriormente. Os níveis plasmáticos caem rapidamente como resultado da redistribuição e posteriormente se segue um período mais prolongado de metabolismo hepático e clearance renal. A meia-vida de redistribuição inicial está entre 2 e 4 minutos. Disfunções hepáticas ou renais leves não alteram a farmacocinética do propofol.
Dentre todos os anestésicos endovenosos, o propofol causa a redução mais proeminente na pressão arterial. Isso ocorre devido à vasodilatação sistêmica que provoca. Pode haver discreto aumento reflexo da frequência cardíaca. A diminuição na pressão arterial é dose-dependente e acontece com maior magnitude em idosos e pacientes em choque. Esse efeito pode ser minimizado pela injeção lenta da medicação, evitando supradosagem inadvertida.
Com exceção da ketamina, todos os agentes de indução anestésica agem sobre o centro respiratório causando depressão ventilatória. Esse efeito é mais pronunciado com o propofol, portanto geralmente se observa um período de apnéia. Além disso, o propofol reduz marcadamente os reflexos faríngeos e de via aérea, característica que o torna ideal para a inserção de máscara laríngea.
Há relatos de associação do propofol com a ocorrência de movimentos epileptiformes durante a indução e recuperação, porém esses movimentos não devem ser confundidos com atividade epiléptica verdadeira – em doses habituais, o propofol é anticonvulsivante. Demonstrou-se também redução no fluxo sanguíneo cerebral, na taxa metabólica cerebral e na pressão intracraniana.
O propofol é comumente utilizado em infusão contínua para sedação de pacientes adultos para procedimentos de pequeno porte, bem como na Unidade de Terapia Intensiva. É também a droga mais empregada para anestesia intravenosa total, Total Intravenous Anaesthesia (TIVA). Existem diversos regimes de infusão, porém uma discussão detalhada está fora do escopo deste tutorial.
A infusão de propofol está contraindicada para sedação em crianças devido a questionamentos quanto à sua segurança. Uma “síndrome da infusão de propofol” foi descrita, crianças afetadas desenvolveram acidose metabólica, hiperlipidemia, arritmias cardíacas e aumento na mortalidade.
As evidências sugerem que o propofol é seguro para uso em pacientes suscetíveis a porfirias.
Etomidato
O etomidato é um éster imidazólico. Sua apresentação é geralmente como emulsão lipídica ou como solução cristalina contendo propilenoglicol numa concentração de 2mg/ml. Dor à injeção é comum e a taxa de tromboflebite no período pós-operatório é alta.
A dose-padrão para indução é 0,3mg/Kg, e a recuperação é rápida devido à redistribuição para músculos e tecido adiposo. A indução da anestesia pode ser acompanhada de movimentos involuntários que podem ser confundidos com atividade epileptiforme generalizada. A recuperação é normalmente desagradável e acompanhada de náuseas e vômitos. O etomidato é rapidamente metabolizado por esterases hepáticas e plasmáticas, formando compostos inativos. A excreção é predominantemente urinária e a meia-vida de eliminação varia de 1 a 5 horas.
O etomidato causa o menor grau de depressão miocárdica entre os anestésicos endovenosos, com redução mínima no débito cardíaco e na pressão arterial. No passado, o etomidato era utilizado amplamente para a indução anestésica em pacientes chocados, idosos ou com comprometimento da função cardiovascular. Todavia, essa droga tem se tornado menos popular recentemente.
Acontece apnéia transitória com o uso do etomidato, porém em menor grau do que com outros fármacos. Podem ocorrer tosse ou soluços. Devido a isso, o etomidato, assim como o tiopental, não é ideal para a inserção de máscara laríngea. Náuseas e vômitos pós-operatórios são comuns após a administração de etomidato.
O etomidato inibe a 11-β-hidroxilase, uma importante enzima na via de produção esteroidal adrenal. Uma dose única de indução bloqueia por 4 a 8 horas o aumento na síntese de cortisol que ocorre como resposta normal ao estresse e esse tempo pode se prolongar até 24 horas em pacientes idosos ou debilitados. Há evidência de aumento na mortalidade com o uso de infusão contínua de etomidato para sedação em pacientes criticamente enfermos. Apesar de não ter sido demonstrado aumento de mortalidade após dose única para a indução anestésica, o uso do etomidato tem diminuído nos últimos anos devido à percepção de morbidade aumentada.
Ketamina
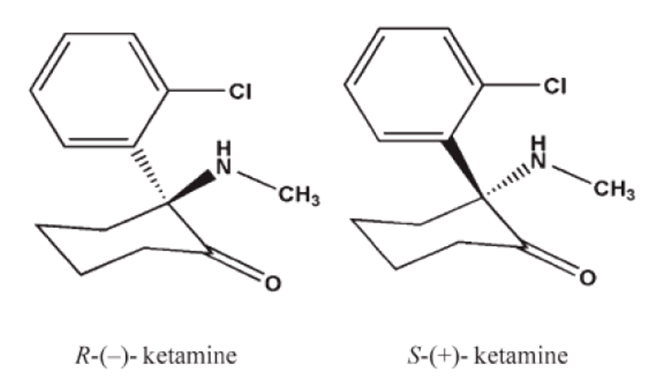
A ketamina é um derivado da fenilciclidina, uma droga dissociativa utilizada no passado como agente anestésico que exibia efeitos alucinógenos e neurotóxicos. Droga dissociativa é aquela que reduz as sinapses vindas de outras áreas cerebrais, principalmente as sensoriais, para a mente consciente. A ketamina existe na forma de dois estereoisômeros, R (dextro) e S (levo) ketamina, conforme a figura acima. Estereoisômeros são moléculas em que os mesmos átomos estão ligados entre si na mesma ordem, porém mostram diferentes arranjos tridimensionais, resultando em imagens em espelho uma da outra, que não podem ser superpostas. A ketamina é apresentada normalmente como uma mistura racêmica dos dois estereoisômeros, porém tem-se disponibilizado a ketamina S devido ao seu perfil farmacológico mais vantajoso, conforme será explicado adiante. Trata-se de uma solução levemente ácida (pH 3,5-5,5) contendo 10, 50 ou 100mg de ketamina por ml. Ampolas padronizadas também contêm um conservante que impede o uso subaracnóide ou epidural. Está disponível, ainda, como pó liofilizado para reconstituição.
A ketamina apresenta propriedades hipnóticas, analgésicas e de anestésico local. Seus efeitos são mediados principalmente pelo antagonismo não-competitivo dos receptores N-metil-D-aspartato (NMDA) no cérebro e medula espinhal. Outros mecanismos de ação da ketamina podem incluir interação com receptores opióides, contudo, o naloxone não antagoniza os efeitos analgésicos da ketamina em humanos.
A anestesia produzida pela ketamina é denominada “anestesia dissociativa”. Esse estado clínico único é exemplificado pela catalepsia, em que os olhos permanecem abertos com olhar fixo com nistagmo e os reflexos corneanos e fotomotor permanecem intactos. Podem ocorrer graus variáveis de hipertonia e ocasionalmente movimentos intencionais não relacionados a estímulos dolorosos, mesmo durante anestesia cirúrgica adequada. Sensações psíquicas que incluem alterações de humor, sensação de flutuação, sonhos vívidos e alucinações são comuns durante a emergência da anestesia com ketamina.
Geralmente, esses efeitos desaparecem com a recuperação completa da consciência. A pré-medicação com benzodiazepínicos diminui essa síndrome confusional aguda durante a emergência.
Como mencionado anteriormente, a molécula de ketamina existe em dois estereoisômeros – ketamina S e R. Esses isômeros exibem diferenças farmacológicas e clínicas. A ketamina-S é três vezes mais potente que a ketamina-R e o tempo de recuperação e sequelas psicomiméticas são reduzidos. No entanto, isso pode ser consequência da redução na dose necessária com o uso da S-ketamina, que é mais potente.
A ketamina é única entre os agentes de indução anestésica por ser passível de administração endovenosa, intramuscular, oral, nasal, renal e epidural (na sua formulação sem conservante). A dose depende da via de administração e do efeito terapêutico desejado. Para indução da anestesia, uma dose de 0,5 a 1,5mg/Kg pode ser administrada EV, ou 4 a 10mg/Kg IM. A latência é maior que a das outras drogas de indução (inconsciência em 1-2 minutos para uso EV) e o parâmetro clínico de avaliação pode ser difícil de determinar em pacientes com o olhar fixo por curtos períodos de tempo. A duração de ação de uma dose única é aproximadamente 5 a 10 minutos. A ketamina é metabolizada no fígado, e metabólitos conjugados são excretados na urina. A meia-vida de eliminação é aproximadamente 2,5 horas.
A combinação de efeitos cardiovasculares da ketamina é única. A sua administração, ao contrário dos outros agentes, é associada a taquicardia, aumento da pressão arterial e aumento do débito cardíaco. Esse perfil torna a ketamina útil no paciente chocado.
O efeito da ketamina sobre o drive respiratório é mínimo, apesar de poder ocorrer diminuição transitória na ventilação após administração em bolus. Isso, combinado ao fato de que os reflexos de proteção da via aérea permanecem relativamente preservados, torna a ketamina o anestésico ideal para uso no âmbito pré-hospitalar. Há aumento da salivação, que pode levar a obstrução de via aérea superior, porém esse efeito pode ser diminuído pela pré-medicação com antimuscarínicos como por exemplo o glicopirrolato. A ketamina é um relaxante da musculatura lisa bronquial e, portanto, tem um papel especial no manuseio da asma grave.
No passado, pensava-se que a ketamina aumentasse o fluxo sanguíneo cerebral e a pressão intracraniana, consequentemente limitando seu uso em pacientes com traumatismo crânio-encefálico. Contudo, assegurando-se que hipoventilação e hipercapnia sejam evitadas, isso não ocorre e há alguma evidência de que a ketamina pode ter efeitos neuroprotetores devido à sua ação nos receptores NMDA.
A ketamina parece ser segura para uso nas porfirias.
Midazolam
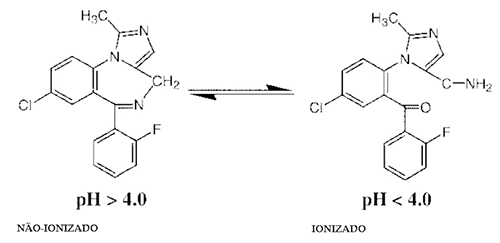
Apesar de não ser um agente de indução endovenoso propriamente dito, o midazolam pode ser utilizado para induzir anestesia devido à sua farmacocinética. Trata-se de um benzodiazepínico hidrossolúvel que é apresentado em solução cristalina, geralmente na concentração de 2mg/ml. O midazolam exibe a forma isomérica conhecida como tautomeria. Na ampola, numa solução ácida, a molécula existe na forma ionizada. Em pH fisiológico, a molécula se torna um anel não-ionizado altamente lipossolúvel, o que explica seu rápido início de ação. Não há dor à injeção.
Assim como outros benzodiazepínicos, o midazolam age especificamente sobre receptores intimamente ligados ao receptor GABA-A. A ativação do receptor benzodiazepínico aumenta o influxo de cloreto para as células neuronais através do receptor GABA-A, causando hiperpolarização neuronal e os efeitos observados clinicamente.
O midazolam é geralmente utilizado para sedação em doses de 0,05 a 0,1mg/kg EV. Suas vantagens nesse contexto são sua curta duração de ação e suas propriedades amnésticas. Em crianças, é útil como pré-medicação – 30 minutos antes da cirurgia, em dose oral de 0,5mg/kg. Pode ser utilizado como agente endovenoso único, na dose de 0,3mg/kg, porém a velocidade de instalação é lenta, limitando seu uso. A duração de ação é aproximadamente 30 minutos, maior do que aquela dos outros agentes de indução. Sofre metabolismo hepático e eliminação renal. Em idosos, o fluxo sanguíneo hepático e a atividade metabólica diminuídos podem resultar em meia-vida significativamente prolongada.
O midazolam tem efeito depressor moderado sobre os sistemas cardiovascular e respiratório, portanto a monitorização é importante durante sedação. Quando usado como agente único de indução, o midazolam causa apnéia em até 70% dos pacientes.
Os efeitos do midazolam podem ser revertidos com flumazenil, um antagonista benzodiazepínico competitivo. Deve ser administrado por injeção endovenosa em incrementos de 100μg e seu início de ação é de aproximadamente 2 minutos. O flumazenil deve ser utilizado com cautela, uma vez que pode causar agitação e convulsões.
RESPOSTAS ÀS QUESTÕES-CHAVE
Tendo revisado a farmacologia dos fármacos endovenosos de uso comum, tente responder às questões apresentadas no início do tutorial.
1. Paciente com obstrução intestinal que necessita de laparotomia de emergência. Que agente de indução você usaria?
Qualquer paciente com obstrução intestinal deve ser considerado como tendo estômago cheio. Tradicionalmente, uma indução em sequência rápida seria realizada com pré-oxigenação, pressão sobre a cartilagem cricóide, tiopental e suxametônio. O tiopental é escolhido devido ao início de ação rápido e bem definido com uma dose pré-determinada. Esse é também o método de indução de escolha para cesariana.
2. Paciente com história de câncer de laringe, com estridor evidente e sinais de insuficiência respiratória, necessita de traqueostomia. Que agente de indução você usaria?
Agentes de indução endovenosa e bloqueadores neuromusculares devem ser evitados nesse caso devido à sua ação depressora sobre a ventilação. Pode não ser possível realizar ventilação sob máscara facial caso esse paciente entre em apnéia. Indução inalatória com halotano ou sevoflurano deve ser empregada.
3. Paciente que necessita de troca de curativo para queimadura. Que agente de indução você usaria?
A ketamina é a droga ideal para ser usada em procedimentos de pequeno porte. Para troca de curativos de queimadura, uma dose sub-anestésica pode ser utilizada. Essa dose promoverá sedação e analgesia, preservando os reflexos de proteção da via aérea. A ketamina é comumente associada à pré-medicação com benzodiazepínicos para reduzir a dose necessária e as reações psicomiméticas quando da emergência da anestesia; eventualmente pode-se utilizar um anti-sialogogo (glicopirrolato, brometo de glicopirrônio) para reduzir as secreções na via aérea.
4. Paciente com história de insuficiência cardíaca necessita de anestesia geral. Que agente de indução você usaria?
Essa é uma pergunta difícil para a qual não há necessariamente uma resposta correta. Para muitos clínicos, o etomidato seria a droga de escolha devido ao seu efeito limitado sobre o sistema cardiovascular. Contudo, outros anestesistas evitariam por completo o uso do etomidato devido à sua ação sobre a síntese esteroidal. A ketamina poderia também ser considerada como consequência da sua estabilidade cardiovascular relativa. O propofol e o tiopental também são opções, porém causam potencialmente mais depressão cardiovascular. A questão essencial é que qualquer agente de indução que seja escolhido deve ser utilizado na menor dose possível, administrado lentamente e titulado conforme seu efeito. Monitorização invasiva da pressão arterial deve ser considerada, se disponível.
5. Que agente de indução seria mais apropriado para um paciente desidratado, hipovolêmico, necessitando de anestesia geral de emergência?
Nessa situação, vasodilatação excessiva comprometeria mais a pressão arterial e a perfusão de órgãos. Ketamina ou etomidato poderiam ser considerados, já que são mais estáveis sobre o sistema cardiovascular, porém como na questão de número 4, para qualquer droga que seja usada, a titulação é fundamental.
6. Paciente com porfiria que é admitido para herniorrafia inguinal e necessita de anestesia geral. Que agente de indução você usaria?
As porfirias são um grupo de doenças caracterizado por superprodução e excreção de porfirinas (compostos intermediários produzidos durante a síntese de hemoproteínas). Episódios agudos podem ser precipitados por fármacos, estresse, infecção, álcool, gestação e jejum prolongado. O propofol seria a droga ideal para a indução nesse caso, uma vez que é seguro para uso em pacientes com porfiria. O tiopental e o etomidato devem ser evitados, já que podem precipitar uma crise.
7. Paciente que necessita de sedação na Unidade de Terapia Intensiva. Que agente de indução você usaria?
Uma infusão de propofol seria uma boa escolha. O midazolam pode ser administrado concomitantemente, ou como uma alternativa ao propofol. O tiopental deve ser evitado devido ao acúmulo, e o etomidato deve ser evitado devido à supressão da síntese esteroidal adrenal.
8. Qual agente de indução se presta adequadamente para anestesia no âmbito pré-hospitalar?
A ketamina é o agente mais utilizado no ambiente pré-hospitalar e em campos de batalha. Sua estabilidade hemodinâmica se adequa bem ao uso em pacientes chocados, e a ventilação e os reflexos de via aérea estão bem preservados quando equipamentos avançados de suporte à via aérea não estão disponíveis ou não são práticos. Outra vantagem é o seu potente efeito analgésico.
LEITURA COMPLEMENTAR
- Peck T, Hill S, Williams M. Pharmacology for anaesthesia and intensive care. Greenwich medical media, 2003.
- Fryer M. Intravenous induction agents. Anaesthesia and intensive care medicine; 5(9): 317-32.
- Pinnock C, Lin T, Smith T. Fundamentals of anaesthesia. Greenwich medical media, 2003.



