Intensive Care Medicine
Points Essentiels
- La thrombectomie mécanique est recommandée pour un AVC dû à l’occlusion proximale des gros vaisseaux cérébraux antérieurs.
- Une évaluation rapide est vitale: Le traitement doit se faire dans les 6 heures qui suivent l’AVC. ‘Le temps c’est du cerveau” est la devise pour le traitement de l’accident vasculaire cérébral ischémique en phase aigüe.
- La tension artérielle doit être surveillée attentivement pendant la procédure avec traitement agressif de l’hypotension.
- La technique d’anesthésie idéale est actuellement un sujet de débat et de recherche.
- L’objectif actuel est de développer des guides multidisciplinaires afin d’améliorer le déroulement, la sécurité et l’accès rapide au traitement.
INTRODUCTION
L’accident vasculaire cérébral est une affection incapacitante, dévastatrice qui met la vie en danger. C’est la deuxième cause de mortalité dans le monde, dont le coût est estimé à 3 milliards de Livre Sterlings par an pour le Service de Santé du Royaume-Uni avec en plus 4 milliards de Livres de perte pour l’économie en productivité, incapacité et soins informels.
Environ 30% des patients meurent dans l’année qui suit un AVC, et 50% des survivants souffrent d’une invalidité de longue durée. Une analyse des patients du troisième Essai Clinique International sur l’AVC (IST-3) a démontré qu’un peu plus d’un tiers étaient encore en vie et indépendants à 6 mois.2 Les patients avec AVC due à l’occlusion d’une artère proximale de gros calibre (30%-50%) représentent une large proportion du fardeau de l’invalidité.
Parmi les AVC, 85% sont d’origine ischémique plutôt qu’hémorragique. L’occlusion des vaisseaux diminue la perfusion et l’apport nutritif, et cause une hypoxie qui engendre la mort cellulaire. Le traitement a pour but de reperfuser par la recanalisation du vaisseau occlus. Les traitements fondés sur des données probantes comprennent la thrombolyse intraveineuse dans les 4 heures et demie, traitement par l’aspirine dans les 48 heures, hémi craniotomie pour les cas d’infarctus malin, et soins adaptés dans un service spécialisé dans le traitement de l’AVC en phase aigue.3
Malheureusement, seulement 20% des patients atteints d’AVC d’origine ischémique se prêtent à la thrombolyse mécanique: les contre-indications comprennent une chirurgie récente, une anticoagulation, et une présentation tardive.1 L’occlusion des gros vaisseaux représente environ 40% des AVC d’origine ischémique; ces patients présentent souvent des thrombi étendus, peu réceptifs à la thrombolyse intraveineuse, ce qui augmente la probabilité d’un AVC plus important et une incapacité sévère.
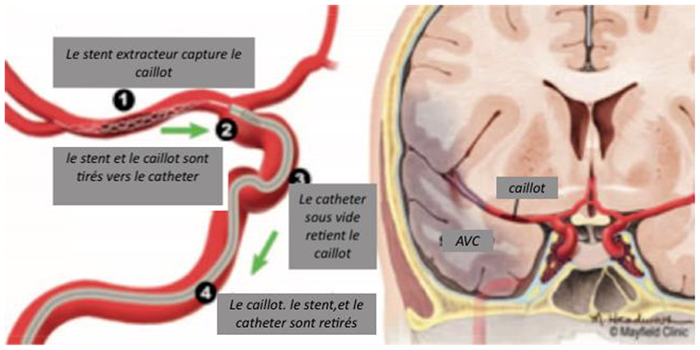
Figure 1. Schéma de la thrombectomie mécanique. Remarquez le thrombus dans l’artère cérébrale moyenne. Un stent retriever en maille est inséré dans le thrombus, et est utilisé pour le tirer de l’artère dans le cathéter sous vide. Permission de MayfieldClinic.com.
Dans ces cas là, le taux de réussite de thrombolyse intraveineuse est inférieur à 30%.4
Des études antérieures se sont concentrées sur les techniques interventionnelles, telles que la thrombolyse guidée par cathéter, l’angioplastie avec ballonnet, et l’infusion locale d’antispasmodiques, pour traiter les AVC résistant à la thrombolyse intraveineuse. Elles n’ont montré aucun bénéfice dans les AVC ischémiques.
Des études récentes ont montré un bénéfice et établissent la thrombectomie endovasculaire mécanique comme la norme de soins pour l’occlusion des vaisseaux de gros calibre de la circulation antérieure responsable d’AVC ischémique aigüe6 (Figure 1). Une méta-analyse a révélé que 46% des patients qui subissent une thrombectomie mécanique retrouvent un état fonctionnel indépendant contre 26% de ceux qui reçoivent le meilleur traitement médical.4 Les progrès dans la technologie du stent retriever (Figure 2), l’utilisation répandue de l’imagerie vasculaire (angioTDM), et les améliorations dans le processus de sélection des patients entraînant des temps rapides entre admission et recanalisation, sont probablement à l’origine de ces meilleurs résultats.6
Les patients avec une occlusion proximale de la carotide interne ou de l’artère cérébrale moyenne sont les plus en mesure de profiter d’une thrombectomie mécanique. Sur 5 patients dont l’occlusion de la circulation antérieure cérébrale est traitée par la thrombectomie mécanique, il y en aura un de plus indépendant à 3 mois si on compare avec la thrombolyse intravasculaire et 1 sur 3 sera moins handicapé (un point en moins sur l’échelle d’handicap modifié de Rankin).1
Un traitement rapide est important : « le temps c’est du cerveau » dans le traitement de l’AVC aigüe. Une étude a montré une chute des avantages de 3,4% à 3,9 % pour chaque heure de délai.1
Ce tutorial décrit les problèmes anesthésiques et la gestion des patients qui présentent un AVC ischémique pour thrombectomie mécanique endovasculaire.

Figure 2: Stent Retriever de 3ème génération. (A) Solitaire (Covidien). (B) caillot sanguin à l’intérieur du stent. Images obtenues sous la loi relative à la liberté de la création (creative commons licence) référence: Kang, D. and Park, J. (2017).Traitement de l’AVC portant sur la thrombectomie avec le stent retriever et l’aspiration directe du caillot : Revue historique et application actuelle. Journal de la Société Coréenne de Neurochirurgie 60(3), pp. 335–347.
INDICATION
Les indications de thrombectomie mécanique vont sûrement s’élargir. Les essais ESCAPE7 and REVASCAT8 comprenaient des patients avec présentation tardive pour la thrombectomie mais dont l’image était propice selon angioTDM. Ces études laissent à supposer que, dans certains cas, ce traitement pourrait en fait être indiqué jusqu’à 24 heures après le début de l’AVC.
Les directives internationales recommandent le traitement mécanique comme norme de soins pour les patients qui présentent un AVC ischémique aigüe dû à l’occlusion d’un vaisseau intracrânien de gros calibre identifié sur l’imagerie vasculaire.9
L’imagerie intracrânienne sous forme d’angioTDM est conseillée pour décider de la conduite à tenir et est utile pour évaluer le flot collatéral. Des occlusions en tandem comme celles de l’artère carotide intra et/ou extra-crânienne sont souvent rencontrées. Bien qu’il n’y ait aucune recommandation précise pour leur gestion, les radiologues interventionnels peuvent faire soit une angioplastie soit placer un stent au moment de la thrombectomie pour traiter la lésion primaire. L’imagerie par résonance magnétique pourrait jouer un rôle dans l’avenir pour évaluer le volume ischémique et les tissus récupérables.4
L’échelle de L’AVC de l’Institut National de la Santé (NIHSS) permet de quantifier le degré de d’incapacité causé par l’AVC. Elle est composée de 11 éléments, un score de 0 à 4 est attribué a chacun. Le score de chaque élément est ajouté pour former le total. Un score de 0 : pas de AVC, 1 à 4 : AVC mineur, 5 à 15 : AVC modéré, 16 à 20 : AVC grave, et 21 à 42 : AVC très grave.10
Les Directives Cliniques du Royaume Uni pour l’AVC (5ème édition, 2016) font les recommandations suivantes :
- L’extraction du caillot artériel (en utilisant les techniques du stent retriever avec ou sans l’aspiration, précédée par la thrombolyse si celle-ci n’est pas contre-indiquée), devrait être envisagé pour les patients qui présentent une occlusion d’un gros vaisseau intracrânien responsable d’un déficit neurologique handicapant (National Institutes of Health Stroke Scale [NIHSS] score 6 ou supérieur) si la procédure (ponction artérielle) peut commencer dans les 5 heures qui suivent le début de l’AVC.9
- De même, on peut envisager l’extraction du caillot artériel (en utilisant les techniques du stent retriever avec ou sans l’aspiration, précédée par la thrombolyse si celle-ci n’est pas contre-indiquée), pour les patients qui présentent un AVC ischémique avec déficit neurologique sévère (NIHSS score 6 ou plus.) au-delà d’un délai de 5 heures entre ponction artérielle et la survenue de l’AVC si :
- l’occlusion de l’artère de gros calibre fait partie de la circulation postérieure, auquel cas le traitement peut-être indiqué jusqu’à 24 heures après le diagnostic.
- on a la preuve que le tissu cérébral est récupérable d’après l’imagerie, auquel cas le traitement jusqu’à 12 heure après le diagnostic peut-être appropriée (maintenant jusqu’à 24 heures suite à l’étude de Dawn).11
Contre-indications absolus à la thrombectomie en phase aigue 12:
- Sévère allergie au produit de contraste,
- Sévère coagulopathie,
- Suspicion d’hémorragie intracrânienne.
- Difficulté technique établie par le neuroradiologue interventionnel (i.e. : vaisseaux tortueux, impossibilité d’accès au caillot, siège du caillot, occlusion carotidienne chronique).
Contre-indications relatives:
- Morbidité importante précédent l’AVC (non autonome ou dont la durée de vie est < 6 mois.
- Accès vasculaire difficile tel que présence d’un anévrisme aortique abdominal de large diamètre, pontage aorto-bifémoral ou fémoro- poplité.
- Plus de 6 heures entre le début des symptômes et la ponction de l’aine (cependant décision du praticien si l’imagerie est propice)
- Le traitement anticoagulant augmente les risques de la procédure.
- Les maladies rénales : possible aggravation avec l’utilisation des produits de contraste.
L’exemple ci-dessous montre l’effet de la revascularisation de l’occlusion de l’artère cérébrale moyenne par la thrombectomie mécanique. (Figure 3)
EVALUATION PRE-PROCEDURALE
La thrombectomie est une procédure urgente qui nécessite une communication rapide et une bonne coordination entre l’unité neuro-vasculaire, le neuroradiologue interventionnel et l’anesthésiste. L’anesthésiste peut faire partie de l’équipe au départ ou peut être sollicité en cas de complication de la procédure.13, 14
Les considérations anesthésiques pré-procédure sont les suivantes :
- L’évaluation préopératoire rapide et appropriée comprenant le niveau de conscience, l’état de jeune, les allergies, l’évaluation des voies aériennes et l’état hémodynamique.
- Mise en place de dispositions pratiques en cas de complication intra-opératoire, qui pourrait nécessiter une intubation et/ou un transfert au bloc opératoire.
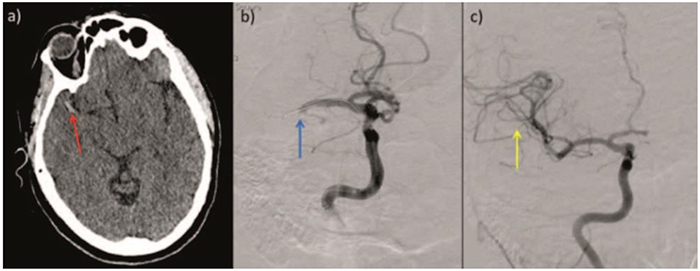
Figure 3. (a) Pré-thrombectomie. (b) Angiogramme de soustraction numérique chez une femme de 49 ans après l’apparition subite d’une hémiparésie gauche. (c) Post thrombectomie. La flèche rouge montre un caillot hyperdense dans l’artère cérébrale moyenne droite (ACM). La flèche bleue montre l’ACM droite occluse traversée par le cathéter. La flèche jaune montre la reperfusion de l’ACM. Apres la procédure, la patiente a démontré une résolution complète de ses symptômes neurologiques.4 Image obtained under creative commons licence reference: Evans M, White P, Cowley P. et al. Revolution in acute ischaemic stroke care: a practical guide to mechanical thrombectomy. Pract Neurol 2017; 17: 252–265.
- Surveillance hémodynamique et utilisation de vasopresseurs pour atteindre les valeurs cibles de la pression artérielle.
- L’anesthésiste doit aussi prendre en compte le fait que l’unité de neuroradiologie interventionnelle est un lieu peu familier, avec ses limites en ce qui concerne l’espace disponible, la gamme de l’équipement anesthésique disponible, les médicaments et la nécessité de porter des vêtements de radioprotection en plomb.13,14
Comme la thrombectomie mécanique est une procédure urgente qui nécessite une coopération rapide et précise entre plusieurs spécialités médicales, une communication claire et précise est vitale pour assurer le succès de de la procédure. La check-list de sécurité pré-procédure en est un élément majeur. Ceci pourrait constituer une nouvelle version de la check-list de l’Organisation Mondiale de la Santé, bien que des unités aient déjà fait la leur (Figure 4).
LA PROCEDURE DE THROMBECTOMIE MECANIQUE
La thrombectomie mécanique est une intervention par cathéter utilisant des stent retrievers auto-expansible et pouvant être rengainés. Ils sont capables de pendre le caillot avec fermeté dans toute sa longueur. Ils éliminent les inconvénients associés avec les stents implantés de façon permanente telle que pour les thromboses et sténoses, qui nécessitent une double anti-agrégation plaquettaire.15
Les stents retrievers diffèrent en fonction du matériel et de la forme de leur ouverture proximale ou distale (i.e. extrémités ressemblant à un panier fermé). Les dispositifs les plus modernes obtiennent une meilleure revascularisation et une réduction des hémorragies intracrâniennes par rapport aux plus anciens.15
La figure 5 montre un exemple d’approche de la procédure.
Bien qu’il y ait peu de données pour guider la gestion dans les cas où une sténose de l’artère carotidienne rend l’accès au caillot difficile, le neuroradiologue interventionnel pourrait avoir besoin d’effectuer une angioplastie pour contourner ce problème.4
Si un stent est laissé dans l’artère carotidienne, il est actuellement recommandé de prescrire une double anti-agrégation plaquettaire pendant 3 à 6 mois, cette période étant déterminée par l’équipe de neurologie.14 La double anti-agrégation plaquettaire pourrait aggraver les complications hémorragiques, mais ceci est compensé par l’augmentation du taux de recanalisation et une réduction de la mortalité ce qui a été publié dans les cas où les stents ont été déployés à cette fin.4
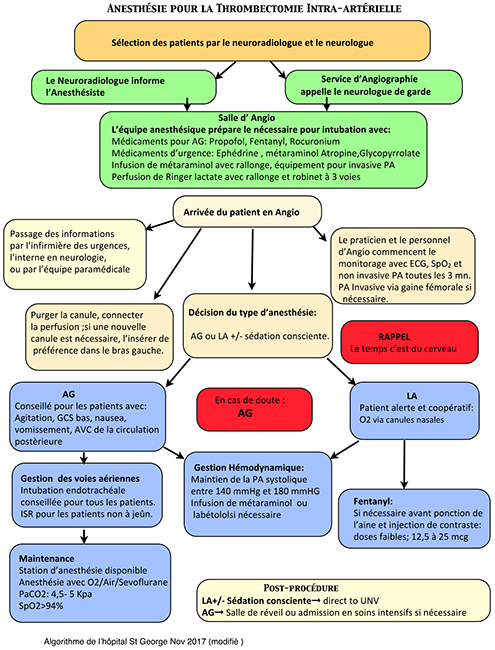
Figure 4. Exemple d’un algorithme qui détaille une check-list et le déroulement des soins pour les patients qui subissent la thrombectomie. Reproduit avec autorisation de St George’s University Hospital NHS Foundation Trust, London.
GESTION DE L’ANESTHESIE DURANT LA PERIODE PERI-OPERATOIRE
Le monitorage anesthétique standard comprenant l’électrocardiogramme, mesure de tension artérielle non-invasive, et oxymètre de pouls est mis en place. La surveillance de la température est routine avec l’anesthésie générale. Le cathéter urinaire n’est pas essentiel car il peut retarder le début de la procédure.
Objectifs hémodynamiques
Le monitorage de la pression artérielle par voie invasive est utile afin de cibler les objectifs hémodynamiques, mais le cathétérisme artériel ne doit pas retarder la thrombectomie. L’onde donnée par la gaine fémorale (introduite par le neuroradiologue interventionnel) peut être transduite si c’est nécessaire.
Soixante pour cent des patients ont une pression artérielle élevée. Ceci peut être dû à une hypertension artérielle essentielle préexistante, une réponse de stress neuroendocrinienne, ou le réflexe de Cushing dû à l’oedème ou l’ischémie cérébrale.
Que les tensions artérielles soient élevées ou basses, elles sont associées à des taux de mortalité et de dépendance plus élevés. Un juste milieu existe entre une hypertension excessive qui contribue à une augmentation du risque d’hémorragie intracrânienne et d’oedème cérébral, et une perfusion cérébrale compromise jusqu’à la pénombre ischémique dû à une pression artérielle moyenne inadéquatement basse.13
Les objectifs hémodynamiques initiaux ont pour but de maintenir la pression artérielle systolique du patient au-dessus de 140 mm Hg avec expansion volumique et vasopresseurs. Une étude de Whalin en 2017 suggérait de maintenir la pression artérielle dans les 10% de la pression artérielle moyenne normale du patient. La pression artérielle systolique devrait être maintenue à moins de 180 mm Hg avec ou sans l’administration de la thrombolyse intraveineuse. La pression artérielle diastolique devrait être maintenue à 105 mm Hg. Après recanalisation, les limites de la tension artérielle peuvent être ajustées pour prévenir les hémorragies. Si la procédure échoue, la pression artérielle systolique devrait être maintenu supérieure à 140 mm Hg.12
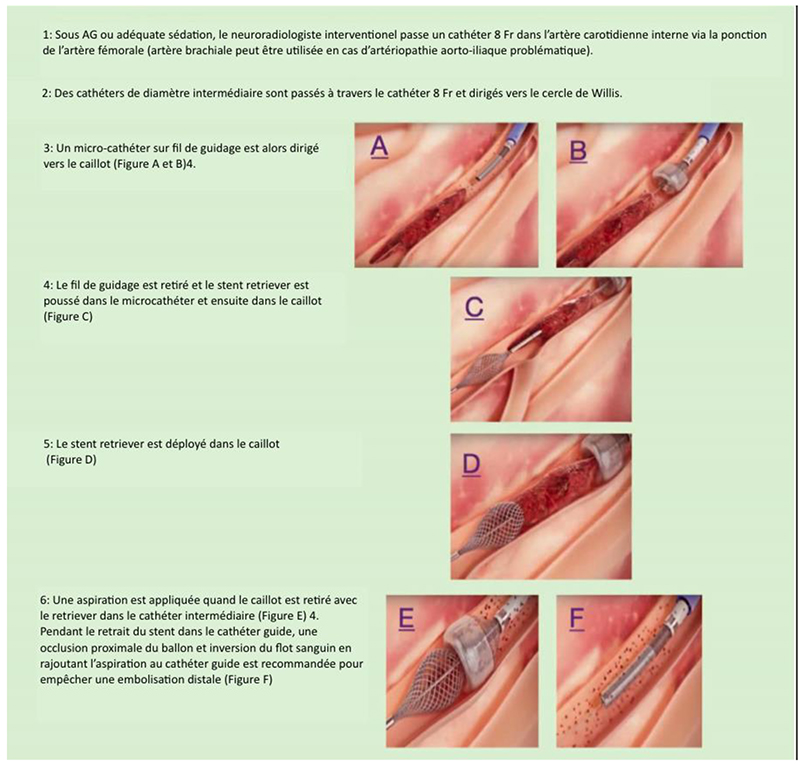
Figure 5. Figure de la Thrombectomie mécanique avec le système Megavac : Etapes 1 à 4, Schéma de la Thrombectomie mécanique utilisant le système Megavac: étapes 1 à 4, mise en place initiale du câble en utilisant le système de délivrance, passage du cathéter, et du stent retriever à travers le thrombus et déploiement du ce stent retriever dans le thrombus. Etape 5, retrait du thrombus et du stent dans le cathéter guide avec aspiration. Etape 6, reperfusion du vaisseau. Images obtained under creative commons license from Capture vascular http://www.capturevascular.com. Accessed at Link: https://www.youtube.com/watch?v=9Yxu4L2klHQ&t¼13s.
ANESTHESIE LOCALE OU ANESTHESIE GENERALE ?
La procédure peut être faite sous anesthésie générale ou locale. L’anesthésie générale permet d’assurer l’immobilité du patient pour le neuroradiologue interventionnel, le contrôle de la douleur et de l’agitation du patient et en plus une protection des voies aériennes définitives. Cependant, la plupart des procédures peuvent être performées sous anesthésie locale avec ou sans sédation consciente, ce qui permet la surveillance continue des changements neurologiques avec un meilleur contrôle sur le plan hémodynamique et une réduction perceptible du temps entre « admission et ponction ».4,13,14
Les inconvénients de l’anesthésie locale sont l’absence de protection des voies aériennes, la douleur non contrôlée, et l’agitation si la procédure se prolonge au-delà d’1 ou 2 heures. Les indications pour l’anesthésie générale sont les suivantes4,13, 14:
- Niveau de conscience réduit
- Impossibilité de protéger les voies aériennes, évidence d’aspiration ou d’hypoxie.
- Signes de trouble du tronc basilaire
- Paralysie bulbaire
- Agitation ou impossibilité de rester allongé à plat à cause d’une maladie cardiaque ou respiratoire2
La technique anesthésique fait actuellement l’objet d’un débat. Des études précédentes ont montré que l’anesthésie générale est associée avec une augmentation de décès et de la durée du séjour par rapport à l’anesthésie locale.17 C’est important de noter qu’il s’ agit d’une association plutôt qu’ une relation de cause à effet : une étude faite en 2010 avait démontré des scores de NIHSS plus élevés chez les patients qui avaient ensuite reçu une anesthésie générale.18 L’anesthésie générale (ou peut-être sa nécessité) a été citée comme un facteur indépendant de prédiction de mauvais résultats. L’anesthésie locale sans sédation représentait 60% de chance de bons résultats comparés au 15% dans le groupe de l’anesthésie générale. Les bons résultats étaient associés avec une pression artérielle systolique supérieure à 140 mm Hg, alors qu’une corrélation était constatée entre une pression artérielle systolique inférieure et l’anesthésie générale.
Comme pour de nombreuses procédures réalisées chez des patients très malades, il peut s’avérer difficile d’attribuer l’anesthésie générale comme facteur indépendant de prédiction de mauvais résultats lorsqu’ on considère des études rétrospectives. Dans la plupart des études, la comparaison est binaire : comparant seulement l’anesthésie générale avec l’anesthésie locale sans tenir compte des différentes pratiques en ce qui concerne les niveaux de sédation ou le recours à l’anesthésie générale suite à des complications. Dans les études rétrospectives, des biais sont facilement engendrés par les directives locales et la préférence de l’opérateur.
Il faut aussi souligner que l’anesthésie générale peut être choisie pour les patients en moins bon état de santé qui présentent des troubles neurologiques sévères, de l’hypotension, ou des signes d’aspiration. Ces patients avaient un score NIHSS élevé au départ avec une pression artérielle basse initialement et des variations observées tout le long de la procédure.18 Dans une étude, les patients sous anesthésie générale prenaient plus longtemps pour arriver en salle d’opération, avec une pression artérielle plus basse et des variations de pression observées tout au long de la procédure.13
Des données plus récentes n’ont montré aucune différence pour les résultats immédiats, par rapport au score NIHSS, entre l’anesthésie générale avec intubation par rapport à la sédation consciente. En 2017, les études GOLIATH et ANSTROKE ont démontré que l’anesthésie générale et la sédation consciente étaient aussi sures l’une que l’autre.4
L’amélioration continue des techniques de procédure, les parcours de soins, la technologie du stent retriever, et l’expérience des équipes médicales sont susceptibles d’influencer les futurs résultats. Des études sont en cours pour déterminer la meilleure solution anesthésique : anesthésie générale ou sédation consciente. En attendant, une technique adaptée à chaque patient et aux circonstances cliniques est sans doute la plus prudente.
Pour l’anesthésie générale, l’induction et le choix des agents de maintenance dépendent de l’anesthésiste. Les besoins analgésiques pour cette procédure sont minimes dû sa nature peu invasive ; les opioïdes de longue durée sont à éviter pour faciliter un examen neurologique rapide après émergence.13,14 La maintenance peut se faire par agent inhalé (quand l’évacuation des gazs est possible) ou par voie intraveineuse. Tous les deux entraînent une récupération rapide, ce qui est important pour l’examen neurologique après la procédure.
Pour une anesthésie locale, l’infiltration de la plaie peut être supplémentée par des injections de fentanyl et de midazolam à la demande durant la sédation. Les infusions contrôlées à faible dose de propofol, rémifentanyl, ou dexmédétomidine sont des options valables pour la sédation consciente. Quelques patients se plaignent de céphalée pendant la procédure, qui peut être causée par le déplacement du cathéter, la dilatation des structures vasculaires au moment du retrait du caillot, ou l’injection de produit de contraste. Le rémifentanil à faible dose peut apporter une analgésie puissante et à l’avantage de maintenir le niveau de conscience avec une rapide terminaison de ses effets.
Soins post-opératoires
Finalement, la récupération neurologique dépend de la recanalisation, et en cas de succès, la récupération neurologique est souvent immédiate une fois que la sédation est réduite. Si la fonction neurologique est acceptable après la procédure, la plupart des patients peuvent être admis dans l’unité neurovasculaire après une intervention sans complications sous anesthésie locale avec sédation minimale.12 Le patient aura probablement besoin de soins intensifs si une anesthésie générale a été nécessaire ou si la procédure a été prolongée ou compliquée. La priorité sera vraisemblablement de suspendre la sédation rapidement et d’ extuber aussitôt que possible. Les infusions de vasopresseurs ou de médicaments anti hypertenseurs tel que le labétalol peuvent être nécessaire pour satisfaire les objectifs hémodynamiques.13,14 Les patients peuvent reprendre leur traitement dans les 48 à 72 heures.14
Les soins post-opératoires doivent inclure une inspection régulière du site de ponction artérielle. Un scanner de la tête doit être fait dans les 24 heures pour exclure une hémorragie intra -cérébrale. L’aspirine et l’héparine de bas poids moléculaire sont suspendues pendant 24 heures pour l’aspirine et 48 heures pour l’héparine de bas poids moléculaire. Si un stent n’a pas été utilisé et aucune hémorragie n’est décelée sur le scanner de contrôle, 300 mg d’aspirine est prescrit pour une durée maximale de 15 jours ; cette dose est ensuite continuée à titre de prévention secondaire.4 Si un stent a été laissé en place, le double traitement antiplaquettaire avec clopidogrel et aspirine est commencé pour une durée de 3 à 6 mois, au-delà un seul médicament antiplaquettaire est prescrit a titre de prévention à long terme.4 On peut aussi envisager de prescrire d’autre médicaments anticoagulants s’ils sont indiqués (i.e. fibrillation auriculaire). L’équipe de neurologie est en général responsable de la prescription des antiplaquettaires et des anticoagulants dans la phase aigüe et dans le long terme.
Si la procédure est réussie, on peut laisser la pression artérielle se stabiliser vers sa valeur normale : 140 à 160 mm Hg est acceptable. Si la recanalisation est un échec, la pression artérielle doit être maintenu entre 140 mm Hg et 180 mm Hg, et une infusion de vasopresseur ou de labétalol peut être nécessaire pour ce faire.12
CONCLUSIONS
La thrombectomie endovasculaire est considérée comme le traitement idéal pour l’AVC ischémique causé par l’occlusion d’un vaisseau de gros calibre de la circulation cérébrale antérieure. La technologie du stent et l’expérience pratique ne cesse de progresser avec le développement de services spécialisés dans le traitement des AVC ischémiques. Les indications pour cette procédure sont de nature a s’accroitre dans l’avenir.
Les connaissances sur les indications pour la procédure sont importantes et pertinentes pour l’anesthésiste-réanimateur qui dispense les soins péri-opératoires d’urgence dans les centres de neurochirurgie.
A cause des locations géographiques actuelles des services neurochirurgicaux au Royaume Uni, un modèle de transfert urgent similaire aux urgences neurochirurgicales sera probablement mis en place.4 Comme la disponibilité de l’angioTDM augmente, les anesthésistes-réanimateurs qui ne pratiquent pas dans des centres peuvent être dans l’obligation d’intuber, stabiliser, et de commencer la thrombolyse intra veineuse avant le transfert pour les patients qui présentent un déficit neurologique sévère. La connaissance des protocoles est utile pour assurer un transfert en temps voulu.
Le débat continue pour déterminer la meilleure technique anesthétique. Jusqu’à preuve de données supplémentaires, la technique la plus appropriée pour le patient est celle basée sur l’évaluation des risques. La priorité est d’agir rapidement et de maintenir de façon rigoureuse la pression artérielle dans les limites fixées.
La thrombectomie mécanique est une procédure nouvelle, dont la durée est critique et qui fait intervenir des praticiens de différentes spécialités avec une possibilité réelle d’améliorer les résultats pour les patients. L’anesthésiste a un rôle vital en assurant des soins intra et péri-opératoires appropriés et sécuritaires pour ces patients.
REFERENCES
- NHS England. Evidence review: mechanical thrombectomy for acute ischaemic stroke in the anterior cerebral Circulation. https://www.engage.england.nhs.uk/consultation/clinical-commissioning-consultation-may-2017/user_uploads/mechanicalthrombectomy-policy-proposition.pdf. Accessed on Nov 3, 2017.
- The IST-3 Collaborative Group. The benefits and harms of intravenous thrombolysis with recombinant tissue plasminogen activator within 6h of acute ischaemic stroke (the third International Stroke Trial [IST-3]): a randomized controlled trial. Lancet. 2012;379:2352-2363.
- National Institute for Health and Clinical Excellence. Mechanical Clot Retrieval for Treating Acute Ischaemic Stroke. Interventional Procedures Guidance. London, UK: National Institute for Health and Clinical Excellence. https://www.nice. org.uk/guidance/ipg548/chapter/3-The-procedure. Accessed July 14, 2017.
- Evans M, White P, Cowley P, et al. Revolution in acute ischaemic stroke care: a practical guide to mechanical thrombectomy. Pract Neurol. 2017;17:252-265.
- Higashida R, Halbach V, Tsai F, Dowd C, Hieshima G. Interventional neurovascular techniques for cerebral revascularization in the treatment of stroke. Am J Roentgenol. 1994;163(4):793-800.
- Boyle K, Joundi RA, Aviv RI. An historical and contemporary review of endovascular therapy for acute ischemic stroke. Neurovasc Imag. 2017;3(1):1.
- Goyal M, Demchuk AM, Menon BK, et al; ESCAPE Trial Investigators. Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med. 2015;372(11):1019-1030.
- Molina CA, Chamorro A, Rovira A, et al. REVASCAT: a randomized trial of revascularization with Solitaire FRt device vs. best medical therapy in the treatment of acute stroke due to anterior circulation large vessel occlusion presenting within eight-hours of symptom onset. Int J Stroke. 2013;10:619-626.
- Royal College of Physicians, Intercollegiate Stroke Working Party. National Clinical Guideline for Stroke. 5th ed. 2016. https://www.strokeaudit.org/SupportFiles/Documents/Guidelines/2016-National-Clinical-Guideline-for-Stroke-5t-(1).aspx. Accessed August 10, 2017.
- Wikipedia. National Institutes of Health Stroke Scale (NIHSS). https://en.wikipedia.org/wiki/National_Institutes_of_ Health_Stroke_Scale#cite_note-SST-3. Accessed July 10, 2017.
- Nogueria RG, Jadhav PA, Haussen DC, et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. N Engl J Med. 2018;378:11-21.
- White PM, Bhalla A, Dinsmore J, et al. Standards for providing safe acute ischaemic stroke thrombectomy services. Clin Radiol. 2015;72:175e1-175e9.
- Anastasian ZH. Anaesthetic management of the patient with acute ischaemic stroke. Br J Anaesth. 2014;113:9-16.
- Dinsmore J, Elwishi M, Kailainathan P. Anaesthesia for endovascular thrombectomy. BJA Educ. 2018;18(10):291-299.
- Morasini P, Subler C, Schroth G, Gralla J. Thrombectomy for acute ischaemic stroke treatment: a review. EJMINT. 2012:1238000077. http://www.ejmint.org/invited-review/1238000077. Accessed June 20, 2017.
- Whalin MK, Halenda KM, Haussen DC, et al. Even small decreases in blood pressure during conscious sedation affect clinical outcome after stroke thrombectomy: an analysis of hemodynamic thresholds. Am J Neuroradiol. 2017;32:294-298.
- Bekelis K, Missios S, MacKenzie TA, et al. Anaesthesia techniques and outcomes of mechanical thrombectomy in patients with acute ischaemic stroke. Stroke. 2017;48(2):361-366.
- Jumaa MA, Zhang F, Ruiz-Ares G, et al. Comparison of safety and clinical and radiographic outcomes in endovascular acute stroke therapy for proximal middle cerebral artery occlusion with intubation and general anaesthesia versus the nonintubated state. Stroke. 2010;41(6):1180-1184.



