General Topics
PUNTOS CLAVES
- La isquemia miocárdica perioperatoria puede aumentar la mortalidad a los 30 días cuando resulta en infarto de miocardio.
- Optimizar a los pacientes en riesgo en el preoperatorio cuando el tiempo lo permita.
- Intentar regular la oferta y demanda del miocardio en el intraoperatorio y monitorizar si hay evidencia de isquemia durante el período perioperatorio.
INTRODUCCIÓN
La isquemia miocárdica puede progresar a infarto al miocardio (IM), lo que es importante ya que el IM perioperatorio se asocia con un aumento significativo de la mortalidad a 30 días.1 Este artículo abordará las estrategias preoperatorias, intraoperatorias y postoperatorias para la prevención y manejo de la isquemia miocárdica perioperatoria.
CONSIDERACIONES PREOPERATORIAS
Sistemas de puntuación de evaluación de riesgo
Existen varios sistemas de puntuación que predicen el riesgo de eventos cardiacos adversos mayores.2 Tienden a centrarse en la historia clínica pasada del paciente y los factores de riesgo quirúrgico. El Índice de Riesgo Cardíaco Revisado de Lee es un sistema de puntuación simple, validado y ampliamente utilizado que predice complicaciones cardíacas mayores en cirugía electiva no cardiaca mayor2. Los 6 factores independientes se enumeran en la Tabla 1.
La tasa de eventos cardíacos pronosticados aumenta con el incremento del número de factores de riesgo presentes, que van desde 0.4% -11%: 0 puntos – 0.4%; 1 punto: 0.9%; 2 puntos: 6.6%; > 3 puntos – 11%.2
El índice de riesgo cardíaco de Lee solo está válido para cirugía electiva y no abarca todos los factores de riesgo de eventos cardiacos adversos mayores. Es de destacar que el resultado es un punto final compuesto, no específico para isquemia o infarto al miocardio. Otros factores de riesgo importantes incluyen IM reciente, inserción reciente de stents coronarios, troponina I altamente sensible preoperatoria elevada, cardiopatía valvular, insuficiencia cardíaca descompensada y arritmias. Este artículo discutirá algunos de estos factores de riesgo en mayor detalle.
Intervención Coronaria Percutánea (ICP) reciente
Después de la ICP, hay un riesgo conocido de trombosis en el stent, que disminuye con el tiempo después del procedimiento. La trombosis intra-stent puede causar isquemia miocárdica y se asocia con una mortalidad alta. Con el fin de reducir este riesgo, los pacientes comienzan con agentes antiplaquetarios duales para el período de mayor riesgo; la duración de la terapia es específica para el tipo de stent colocado.

Tabla 1. Índice de Riesgo Cardíaco Revisado de Lee
La terapia antiplaquetaria doble aumenta la susceptibilidad a sangrado perioperatorio. El riesgo de hemorragia debe equilibrarse con el riesgo de trombosis intrastent en relación con el cese temprano de los antiagregantes plaquetarios. Debido a estos factores, las guías de la American Heart Association/American College of Cardiology (AHA/ACC) del 2014 recomiendan que la cirugía electiva sea diferida (Tabla 2) y que la cirugía de urgencia o emergencia tenga una discusión multidisciplinaria sobre el riesgo y beneficio de continuar o suspender los antiagregantes plaquetarios en el perioperatorio.3 La aspirina debe continuarse siempre que sea posible.
IM reciente
Un IM reciente aumenta el riesgo de IM y mortalidad perioperatoria.4 A medida que aumenta el tiempo desde que se produjo el IM, disminuye el riesgo de reinfarto. Un estudio retrospectivo mostró que el riesgo de reinfarto disminuyó del 32,8% cuando la cirugía ocurrió dentro de los 0-30 días del IM comparado con el 5.9% cuando la cirugía ocurrió a los 91-180 días después del infarto de miocardio.4 La probabilidad de reinfarto y la mortalidad claramente disminuyen con el aumento del tiempo de IM, pero actualmente no es posible dar una estimación precisa del riesgo en un punto de tiempo dado después de un infarto. Las directrices americanas recomiendan retrasar la cirugía electiva durante al menos 60 días después del IM cuando sea posible para mitigar este riesgo.3
Optimización
Prueba de Estrés Cardíaco No Invasivo
Las guías de la European Society of Cardiology/European Society of Anaesthesia (ESC/ESA) y de la AHA/ACC del 2014 proponen la prueba de esfuerzo preoperatoria si se cumplen todos los criterios siguientes:
- La cirugía es electiva.
- El paciente tiene una capacidad funcional pobre limitada por angina o dificultad para respirar (< 4 equivalentes metabólicos (METs), o con capacidad funcional desconocida).
- El paciente tiene riesgo perioperatorio elevado de eventos coronarios adversos mayores.
- Las pruebas tendrán un impacto en la toma de decisiones para la atención perioperatoria.3,5
Los pacientes con capacidad funcional excelente (>10 METs) no necesitan someterse a una prueba de esfuerzo. Las guías son menos claras con respecto a los pacientes con riesgo cardíaco elevado y capacidad funcional de moderada a buena (4-10 METs), para quienes “… puede ser razonable renunciar a más pruebas de ejercicio … y proceder a la cirugía.”3
Revascularización Coronaria
Las indicaciones para revascularización coronaria preoperatoria en pacientes con riesgo de isquemia miocárdica son similares a las indicaciones fuera del contexto perioperatorio.3,5 En particular, no se ha demostrado ningún beneficio para la revascularización profiláctica preoperatoria en pacientes con enfermedad coronaria estable o asintomática.6 No se ha demostrado que la revascularización con ICP o cirugía mejore los resultados con la advertencia de que los estudios invariablemente excluyeron a los pacientes con fuerte indicación para cirugía cardíaca, como la enfermedad del tronco principal izquierdo o su equivalente.

Tabla 2. Tiempos Recomendados para la Cirugía No Cardíaca Electiva después de la Intervención Coronaria Percutánea (ICP)3
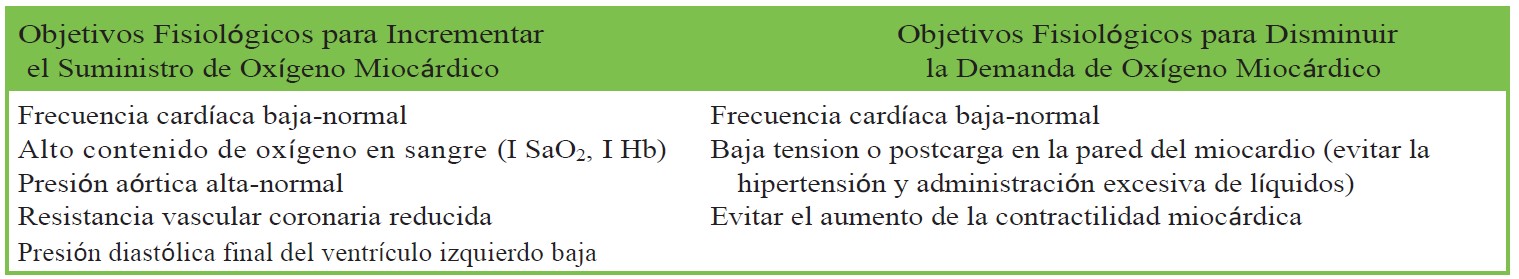
Tabla 3. Determinantes de la Demanda y el Suministro de Oxígeno al Miocardio
Consideraciones sobre la medicación
Beta-Bloqueantes
La literatura existente sobre el uso perioperatorio de beta bloqueantes ha sido enturbiada por investigaciones fraudulentas. Las guías sugieren la continuación de los beta bloqueantes para los que ya los toman, y existe incertidumbre sobre el inicio en pacientes con riesgo de isquemia miocárdica perioperatoria con beta bloqueantes de novo.3,5 La valoración cuidadosa de la frecuencia cardíaca en pacientes de alto riesgo puede ser beneficiosa y fisiológicamente atractivo. Sin embargo, al adoptar un enfoque único ajustado para todos, al tiempo que se reduce el IM, iniciar a los pacientes con beta bloqueantes podría aumentar la mortalidad y el riesgo de eventos cerebrovaculares, probablemente debido a hipotensión inducida por fármacos.
Aspirina
La administración continua de aspirina perioperatoria es polémica luego de un reciente estudio controlado aleatorizado (ECA) que mostró una mayor tasa de sangrado significativo sin mejoría de la mortalidad o reducción de IM no fatal.7 Las guías de consenso actuales recomiendan que en pacientes que están tomando aspirina, la decisión de continuar tomando aspirina se basará en el riesgo individual de sangrado perioperatorio en relación con el riesgo de complicaciones trombóticas.3,5 Existen guías separadas para aquellos que han tenido un síndrome coronario agudo (SCA) o ICP reciente.
Inhibidores de la enzima convertidora de Angiotensina (IECAs) y antagonistas del receptor de angiotensina (ARAs)
Existe controversia con respecto al uso de ARAs e IECAs en el perioperatorio. Las guías americanas sugieren que es razonable continuar su uso,3 mientras que las pautas europeas sugieren suspender el tratamiento si la indicación es para hipertensión.5
Estatinas
Las estatinas pueden reducir la incidencia de IM perioperatorio. Las estatinas deben continuarse si los pacientes ya están con ellas y pueden iniciarse en pacientes sometidos a cirugía vascular al menos 2 semanas antes de la operación,5 aunque no hay ensayos prospectivos a gran escala para confirmar este enfoque.
Clonidina
No hay evidencia del beneficio del uso profiláctico de clonidina preoperatoria.
Cirugía de Emergencia
La cirugía electiva permite tiempo para un estudio exhaustivo y la optimización de pacientes de alto riesgo. Este beneficio a veces se ve compensado por las consecuencias de retrasar la cirugía de emergencia. En estas circunstancias, las guías de la AHA/ACC recomiendan proceder utilizando “estrategias apropiadas de monitoreo y manejo basadas en la evaluación clínica.”3
CONSIDERACIONES INTRAOPERATORIAS
Metas Fisiológicas
Se postulan dos mecanismos principales para causar isquemia miocárdica perioperatoria: ruptura o inestabilidad de la placa coronaria aguda y desequilibrios de la oferta y demanda de oxígeno del miocardio (a menudo en presencia de enfermedad coronaria estable). La contribución proporcional de cada mecanismo es polémica. Los factores que contribuyen incluyen el aumento de la demanda de oxígeno del miocardio a partir de la respuesta simpática al dolor, el trauma y la inflamación, y la reducción del suministro de oxígeno del miocardio por anemia, hipoxia, hipotensión y trombosis arterial por hipercoagulabilidad perioperatoria.
Es el desequilibrio de la oferta y demanda del miocardio la que puede modificarse intraoperatoriamente para prevenir la isquemia miocárdica. El suministro de oxígeno del miocardio se rige por el contenido de oxígeno de la sangre y el flujo sanguíneo coronario. El contenido de oxígeno sanguíneo se determina principalmente por la concentración de hemoglobina y la SaO2 y el flujo sanguíneo coronario se incrementa al aumentar el tiempo diastólico (inversamente proporcional a la frecuencia cardíaca), presión arterial media y calibre de las coronarias. El calibre de las coronarias está controlado en gran medida por la autorregulación metabólica para satisfacer las demandas del miocardio y la tensión de la pared del miocardio. En estados patológicos, el calibre puede reducirse por la aterosclerosis.
La demanda de oxígeno del miocardio aumenta con el incremento de la frecuencia cardíaca, la poscarga, la tensión de la pared del miocardio y la contractilidad miocárdica.
Aunque las técnicas para igualar la oferta y demanda de oxígeno del miocardio parecerían prudentes en el paciente con cardiopatía isquémica, no todas tienen apoyo en la evidencia de mejores resultados.
Oxígeno
La evidencia de emergencia desde el entorno no perioperatorio sugiere que la hiperoxia puede aumentar el tamaño del infarto en la IM aguda con elevación del segmento ST.8 En el contexto perioperatorio, se ha demostrado una asociación estadísticamente no significativa entre la FiO2 alta y el síndrome coronario agudo.9 Aunque se necesita más evidencia, un enfoque pragmático sería mantener saturaciones de oxígeno normales, usando la FiO2 más baja posible.
Frecuencia Cardíaca
Las dosis grandes de agentes profilácticos reductores de la frecuencia cardíaca administrados en el preoperatorio no han demostrado beneficios10. Sin embargo, evitar la taquicardia con una titulación cuidadosa de la analgesia y los beta bloqueantes tiene sentido teórico y no se ha estudiado lo suficiente para desacreditar.
Umbrales para la Transfusión
Débil evidencia sugiere que un umbral de transfusión más alto (como Hb >10,0 g/dL) podría dar mejores resultados para los pacientes con síndrome coronario agudo11; sin embargo, no se ha demostrado beneficio en la supervivencia con mayores umbrales de transfusión para aquellos con riesgo de enfermedad cardiovascular durante el perioperatorio.12 Las guías del National Institute for Health and Care Excellence (NICE) recomiendan un umbral de transfusión restrictivo de 70 g/L a menos que el paciente tenga síndrome coronario aguda, en cuyo caso se recomienda un umbral más liberal de 80 g/L. Se necesita más investigación para aclarar el umbral de transfusión adecuado para pacientes con enfermedad arterial coronaria estable; sin embargo, los pacientes con signos de isquemia o que tienen un riesgo particularmente alto teóricamente pueden justificar un umbral de transfusión de 90 o 100 g/L.
Control de la Temperatura
Algunos estudios sugieren que la hipotermia leve se asocia con mayor isquemia miocárdica perioperatoria y eventos cardíacos en comparación con la normotermia. El mecanismo para esto no se entiende claramente.
Técnica Anestésica
No hay pruebas sólidas para apoyar una técnica anestésica específica para prevenir la isquemia miocárdica.
Anestesia General vs Regional/Neuraxial
Aunque existe cierta controversia, la mayoría de la evidencia sugeriría que no existe una diferencia estadísticamente significativa entre la técnica de anestesia general, neuroaxial o regional.13-15 No está claro si esto se debe a que los estudios carecen de poder o representan un verdadero hallazgo. Una cuestión confusa es que los pacientes de alto riesgo, como los que han tenido un IM o una ICP recientes, tienen más probabilidades de recibir terapia antiplaquetaria, lo que puede excluir las técnicas neuroaxiales y regionales, lo que resulta en una sobrerrepresentación de pacientes de alto riesgo en los grupos de anestesia general.
Óxido Nitroso
La adición de óxido nitroso a un anestésico general no parece aumentar la mortalidad a 1 año o las complicaciones cardiovasculares a los 30 días en pacientes con riesgo de complicaciones cardiovasculares.16
Anestesia Inhalatoria en comparación con la Total Intravenosa (TIVA)
No hay evidencia suficiente para recomendar TIVA o inhalatoria como una opción preferida en la prevención de isquemia miocárdica en la cirugía no cardíaca.
Inhibidores de la Ciclooxygenasa-2 (COX-2)
Existe una opinión de que los inhibidores selectivos de la enzima COX-2 dan como resultado un estado protrombótico que aumenta el riesgo de IM. Dos grandes meta-análisis17 han respaldado esta visión con un mayor riesgo de IM para los que toman inhibidores de la COX-2 en comparación con placebo.
Monitorización Intraoperatoria
Cada paciente tendrá un riesgo de isquemia miocárdica perioperatoria inicial (como se discutió anteriormente) y la monitorización debería ser dictada inicialmente por esto. Las opciones específicas de monitorización incluyen lo siguiente:
Electrocardiograma (EKG)
La monitorización del EKG es un estándar de atención según las recomendaciones de la Association of Anaesthetists of Great Britain and Ireland (AAGBI) para los Estándares de Monitorización Durante la Anestesia y Recuperación. El EKG es un medio de monitorización barato, fácil y no invasivo para isquemia miocárdica. La adición de derivaciones precordiales al EKG de 3 derivaciones estándar en pacientes con riesgo de isquemia miocárdica aumenta su sensibilidad. Un pequeño estudio intraoperatorio indicó que, de forma aislada, las derivaciones V5 y V4 eran más sensibles (75% y 61%, respectivamente). La combinación de derivaciones aumenta la sensibilidad, con V4 y V5 teniendo una sensibilidad del 90%, derivaciones II y V5 con un 80% de sensibilidad y las derivaciones II, V4 y V5 con una sensibilidad del 96%.18 Un estudio más reciente mostró que 2 o más derivaciones precordiales se requieren para lograr una sensibilidad para IM o isquemia de 95% o más.19 El análisis automatizado del segmento ST, si bien no es tan bueno para detectar isquemia, puede alertar al anestesista acerca de los cambios en el EKG.
Medición de la Presión Sanguínea
La hipotensión intraoperatoria tiene una asociación con eventos cardíacos adversos.20 La presión arterial media también es uno de los factores determinantes del suministro de oxígeno al miocardio. De ello se desprendería que la medición precisa y el tratamiento oportuno de la hipotensión (e hipertensión) es importante en aquellos con riesgo de isquemia miocárdica. La colocación de la línea arterial brinda una medición precisa de la presión arterial en tiempo real para ayudar a alcanzar estos objetivos. El potencial de consecuencias adversas de la hipotensión significa que la monitorización de la presión arterial invasiva se debe considerar en pacientes de alto riesgo.
Ecocardiografía Transesofágica (ETE)
La ETE detecta isquemia miocárdica al identificar anomalías en el movimiento de la pared regional. La ETE tiene riesgos y costos asociados, y requiere un operador experimentado. Por estos motivos, no se recomienda la monitorización de rutina de la ETE para aquellos con riesgo de isquemia miocárdica, excepto en respuesta a inestabilidad hemodinámica intraoperatoria persistente.3
Catéter de Arteria Pulmonar
No se recomienda el uso rutinario de catéteres de arteria pulmonar en pacientes de alto riesgo.3,5
Diagnóstico de Isquemia e Infarto
Isquemia Miocárdica Aguda (o Síndrome Coronario Agudo)
La isquemia miocárdica se identifica por los signos o síntomas del paciente o por anomalías en el EKG. Los síntomas de isquemia (como dolor en el tórax, mandíbula o extremidad superior) pueden estar ausentes en el contexto perioperatorio donde se ha administrado la anestesia o analgesia fuerte.21 Otros signos de isquemia incluyen taquicardia, inestabilidad hemodinámica y evidencia de congestión pulmonar (como saturación de oxígeno reducida, compliance pulmonar o sibilancias).
Los criterios del EKG para diagnosticar isquemia miocárdica aguda requieren al menos 2 derivaciones anatómicamente contiguas con lo siguiente22:
IM Agudo
El IM se define como muerte celular del miocardio debido a isquemia miocárdica prolongada. Se diagnostica por22 un aumento del valor del biomarcador cardíaco por encima del límite percentil 99 con al menos 1 de los siguientes:
- i. Síntomas de isquemia,
- ii. Cambios nuevos en la onda T del segmento ST o bloqueo nuevo de rama izquierda,
- iii. Nuevas ondas Q patológicas,
- iv. Evidencia con imagen de nueva pérdida de miocardio viable o anomalía nueva de movimiento de la pared regional.
- v. Identificación de un trombo intracoronario mediante angiografía o autopsia
- O: Muerte cardíaca con síntomas sugestivos de isquemia miocárdica.
Es importante tener en cuenta que los criterios diagnósticos anteriores no se han creado para el entorno perioperatorip. Una troponina elevada después de la cirugía no cardíaca, incluso sin otras características de isquemia aumenta de forma independiente el riesgo de mortalidad a los 30 días.21 Con esto en mente, se ha creado un nuevo diagnóstico perioperatorio-lesión miocárdica después de cirugía no cardíaca (LMCNC). La LMCNC es diagnosticada por un pico de troponina T postoperatoria de 0,03 ng/ml o mayor debido a isquemia miocárdica21. Aunque el diagnóstico de LMCNC tiene importancia pronóstica, la utilidad clínica sigue siendo incierta.
- i. Elevación del ST en el punto J de al menos 1 mm (dependiendo de la ubicación) o
- ii.Depresión del ST de al menos 0,5 mm, y/o inversión de la onda T de al menos 1 mm.
Manejo de la Isquemia Miocárdica
Una vez que se sospecha de isquemia miocárdica, las estrategias de manejo son las siguientes:
Confirmar el Diagnóstico
- i. Obtener un EKG de 12 derivaciones.
- ii. Considerar la realización de un ecocardiograma transesofágico o transtorácico si se detecta inestabilidad hemodinámica.
- iii. Obtener niveles de troponina basales y a las 4 horas.
Optimizar el Balance Oferta y Demanda de Oxígeno del Miocardio
- i. Pausar la cirugía si es apropiado mientras la situación de estabiliza.
- ii. Lograr los objetivos fisiológicos como se mencionó anteriormente: frecuencia cardíaca baja/normal, presión sanguínea normal, saturaciones de oxígeno normal con la menor FiO2 posible, evitar la hipotermia, evitar el exceso de líquidos.
- iii. Administrar medicamentos: beta bloqueantes para lograr una frecuencia cardíaca baja o normal sin hipotensión, considerar dar aspirina (vía sonda nasogástrica si está bajo anestesia general), y una infusión de trinitrato de glicerilo (TNG).
- iv. Considerar e l uso d e l b a l ó n d e c o n t r a p u l s a c i ó n intraaórtico, guiado por cardiólogos.
Considerar Abandonar la Cirugía
Esto será específico de la situación e involucrará una discusión multidisciplinaria. Las consideraciones incluyen lo siguiente:
- i. ¿Qué tan inestable está el paciente?
- ii. ¿Qué tan urgente es la cirugía?
- iii. ¿La cirugía puede detenerse rápidamente si el paciente se deteriora?
Si se continúa con la cirugía, contar con un cirujano experimentado para garantizar el tiempo quirúrgico más corto lo que podría ser beneficioso para el paciente.
Consultar al Cardiólogo
Si hay evidencia de IM con elevación del ST en el EKG, o hay inestabilidad hemodinámica, se recomienda una opinión de cardiología de emergencia para considerar la necesidad de ICP. La trombolisis generalmente está contraindicada si se ha realizado una incisión quirúrgica.
CONSIDERACIONES POSTOPERATORIAS
El manejo posoperatorio será específico para cada paciente, pero las consideraciones incluyen lo siguiente:
- Posicionamiento postoperatorio: considerar una monitorización más intensiva según corresponda, incluida la necesidad de telemetría.
- Considerar la necesidad de EKGs o troponinas seriadas según el índice de sospecha de IM.
- Asegurar el seguimiento por cardiología o revisión del paciente si se sospecha de infarto.
- Asegurar una buena analgesia, euvolemia y la adición de beta bloqueantes (si la presión sanguínea lo permite) para minimizar la taquicardia.
- Mantener saturaciones de oxígeno normales con una oxígeno terapia juiciosa.
- Comenzar aspirina y considerar inhibidores de PGY12 guiado por la opinión de cardiología.
RESUMEN
- La isquemia miocárdica perioperatoria es una entidad importante con implicaciones pronósticas.
- Antes de la operación, los pacientes deberían tener su riesgo perioperatorio clarificado y optimizado cuando el tiempo lo permita.
- El manejo intraoperatorio consiste en una monitorización y una técnica anestésica adecuada, previniendo los desequilibrios de oferta y demanda de oxígeno del miocardio e identificando y tratando la isquemia miocárdica intraoperatoria.
- Las consideraciones posoperatorias dependerán de los eventos intraoperatorios y de la categoría de riesgo del paciente, pero pueden implicar monitorización intensiva y revisión por cardiología.
REFERENCIAS Y LECTURA ADICIONAL
- Devereaux P, Xavier D, Pogue J, et al. Characteristics and short-term prognosis of perioperative myocardial infarction in patients undergoing noncardiac surgery: a cohort study. Ann Intern Med. 2011;154(8):523-528.
- Lee TH, Marcantonio ER, Mangione CM, et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation. 1999;100(10):1043-1049.
- Fleisher LA, Fleischmann KE, Auerbach AD, et al. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2014;64(22):e77-e137.
- Livhits M, Ko CY, Leonardi MJ, Zingmond DS, Gibbons MM, de Virgilio C. Risk of surgery following recent myocardial infarction. Ann Surg. 2011;253(5):857-864.
- Kristensen SD, Knuuti J, Saraste A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur Heart J. 2014:ehu282.
- McFalls EO, Ward HB, Moritz TE, et al. Coronary-artery revascularization before elective major vascular surgery. N Engl J Med. 2004;351(27):2795-2804.
- Devereaux P, Mrkobrada M, Sessler DI, et al. Aspirin in patients undergoing noncardiac surgery. N Engl J Med. 2014;370(16):1494-1503.
- Stub D, Smith K, Bernard S, et al. Air versus oxygen in ST-segment elevation myocardial infarction. Circulation. 2015;131(24):2143-2150.
- Fonnes S, Gogenur I, Søndergaard ES, et al. Perioperative hyperoxia—long-term impact on cardiovascular complications after abdominal surgery, a post hoc analysis of the PROXI trial. Int J Cardiol. 2016;215:238-243.
- Group PS. Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE trial): a randomised controlled trial. Lancet. 2008;371(9627):1839-1847.
- Carson JL, Brooks MM, Abbott JD, et al. Liberal versus restrictive transfusion thresholds for patients with symptomatic coronary artery disease. Am Heart J. 2013;165(6):964-971. e961.
- Carson JL, Sieber F, Cook DR, et al. Liberal versus restrictive blood transfusion strategy: 3-year survival and cause of death results from the FOCUS randomised controlled trial. Lancet. 2015;385(9974):1183-1189.
- Guay J, Parker MJ, Gajendragadkar PR, Kopp S. Anaesthesia for hip fracture surgery in adults. Cochrane Library. 2016. Feb 22;2:CD000521.
- Group GTC. General anaesthesia versus local anaesthesia for carotid surgery (GALA): a multicentre, randomised controlled trial. Lancet. 2009;372(9656):2132-2142.
- Chu C-C, Weng S-F, Chen K-T, et al. Propensity score–matched comparison of postoperative adverse outcomes between geriatric patients given a general or a neuraxial anesthetic for hip surgery: a population-based study. Anesthesiology. 2015;123(1):136-147.
- Myles PS, Leslie K, Chan MT, et al. The safety of addition of nitrous oxide to general anaesthesia in at-risk patients having major non-cardiac surgery (ENIGMA-II): a randomised, single-blind trial. Lancet. 2014;384(9952):1446-1454.
- Chen LC, Ashcroft DM. Risk of myocardial infarction associated with selective COX-2 inhibitors: meta-analysis of randomised controlled trials. Pharmacoepidemiol Drug Saf. 2007;16(7):762-772.
- London MJ, Hollenberg M, Wong MG, et al. Intraoperative myocardial ischemia: localization by continuous 12-lead electrocardiography. Anesthesiology. 1988;69(2):232-241.
- Landesberg G, Mosseri M, Wolf Y, Vesselov Y, Weissman C. Perioperative myocardial ischemia and infarction identification by continuous 12-lead electrocardiogram with online ST-segment monitoring. Anesthesiology. 2002;96(2):264-270.
- Walsh M, Devereaux PJ, Garg AX, et al. Relationship between intraoperative mean arterial pressure and clinical outcomes after noncardiac surgery toward an empirical definition of hypotension. Anesthesiology. 2013;119(3):507-515.
- Botto F, Alonso-Coello P, Chan M, et al. Myocardial injury after noncardiac surgery: a large, international, prospective cohort study establishing diagnostic criteria, characteristics, predictors, and 30-day outcomes. Anesthesiology. 2014; 120(3):564-578.
- Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HD. Third universal definition of myocardial infarction. Circulation. 2012;126(16):2020-2035.



