Paediatric Anaesthesia
PONTOS-CHAVE
- A diabetes mellitus é o transtorno endócrino mais comum em crianças.
- O período perioperatório pode prejudicar o controle glicêmico, resultando em hipo e hiperglicemia.
- O manejo multidisciplinar é importante para otimizar o controle glicêmico e minimizar as complicações.
- A terapia com bomba de insulina está aumentando em crianças, e os anestesistas devem se familiarizar com o manejo.
- As bombas de insulina contêm apenas insulina de ação rápida e, por isso, a desconexão pode levar a hiperglicemia e cetoacidose diabética.
INTRODUÇÃO
A diabetes mellitus (DM) é um transtorno endócrino multissistêmico causado pela destruição autoimune mediada de células beta produtoras de insulina (tipo 1) ou uma falta relativa de insulina endógena combinada com resistência à insulina (tipo 2).¹ É o transtorno metabólico mais comum na infância, com ocorrência estimada em aproximadamente 497 mil crianças no mundo todo.² A auditoria nacional de diabetes pediátrica no Reino Unido identificou 28.443 crianças e jovens com a condição: 96% com DM tipo 1 (27.115 no total) e 2,2 com DM tipo 2 (621 no total).³ DM relacionada a fibrose cística representa 0,6% do total de casos. A prevalência de crianças com DM tipo I no Reino Unido é de 195,4 a cada 100 mil na população geral. Esta é a maior da Europa. A incidência de DM tipo I é de 25,9 a cada 100 mil na população geral do Reino Unido, e, em 2015-2016, isso aumentou em comparação aos anos anteriores.4 Esse aumento é maior em crianças mais jovens; contudo, a idade pico de diagnóstico continua sendo de 10 a 14 anos.²
ETIOLOGIA
A DM tipo 1 é uma condição autoimune que resulta na destruição de células-beta produtoras de insulina nas ilhotas de Langerhans no pâncreas. É provavelmente causada pela combinação de fatores genéticos e ambientais. A presença de antígenos HLA DR3 e DR4, bem como um histórico familiar positivo (3% das crianças desenvolvem DM tipo 1 se ambos os pais forem afetados) aumentam o risco da doença.5 Os fatores ambientais que levam ao desenvolvimento de autoanticorpos na DM tipo 1 continuam desconhecidos, mas imagina-se que infecções virais e fatores da dieta possam desempenhar um papel.5
A DM tipo 2 esta sendo cada vez mais diagnosticada na infância, mais frequentemente no começo da adolescência, por volta da época da puberdade. Os fatores de risco incluem obesidade, gênero feminino, minoria étnica, e um histórico positivo em parente de 1º ou 2º grau.6,7
Há outras causas menos comuns de diabetes em crianças. Essas são mostradas na Tabela 1.
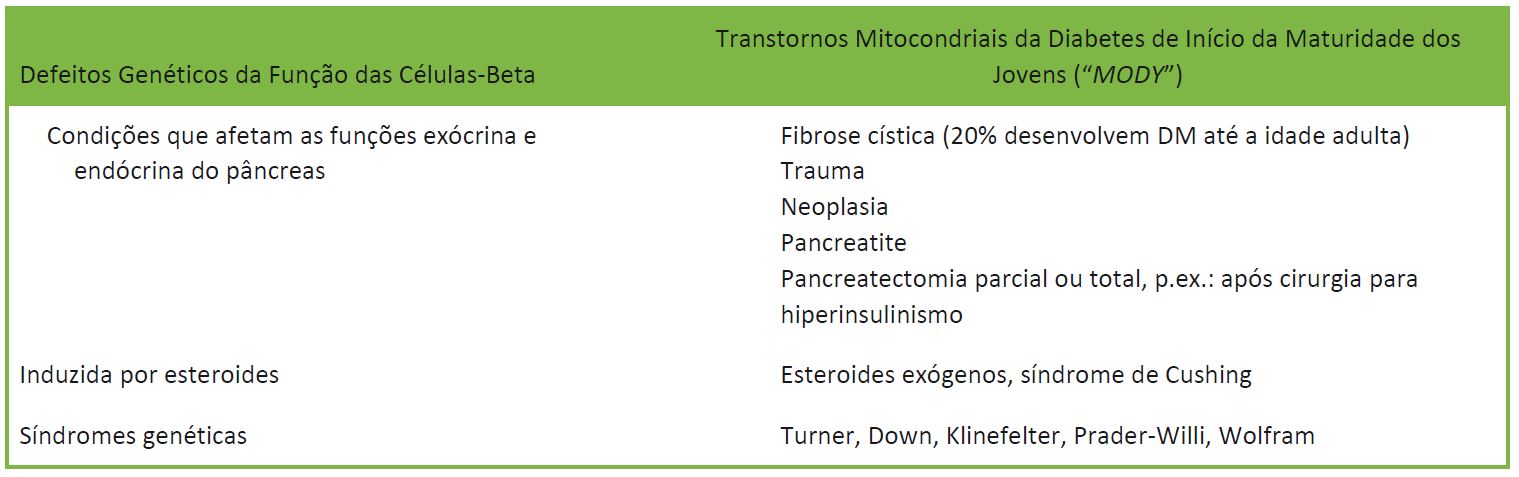
Tabela 1. Causas menos comuns de diabetes em crianças
DIAGNÓSTICO
Os sintomas em crianças que sugerem DM incluem polidipsia, poliúria, perda de peso e cansaço.8 Os critérios de diagnóstico da Organização Mundial da Saúde são ou uma glicose de plasma em jejum >126mg/dL ou uma glicose pós-prandial ou pós-carga de glicose de 75-g >200 mg/dL.9
MANEJO
A meta do controle glicêmico é minimizar complicações agudas e crônicas. A DM tipo 1 requer tratamento com insulina. A DM tipo 2 pode ser manejada por intervenções no estilo de vida e hipoglicemiantes orais, e potencialmente requer terapia com insulina.2
Manejo da DM Tipo 1
Há vários regimes de insulina disponíveis para imitar a insulina endógena normal do corpo. A insulina pode ser categorizada em formas de ação rápida, intermediária e longa, dependendo da duração de sua ação. A maioria dos tratamentos usa uma combinação de insulina de ação longa uma ou duas vezes por dia pela manhã junto com insulina de ação rápida com as refeições, também conhecida como um regime de bolus basal. A dose de insulina exigida depende de uma variedade de fatores, incluindo a idade, fase da puberdade, peso, gênero, rotina diária, exercícios, fase da diabetes, monitoramento de hemoglobina glicada (HbA1c) e de glicose, doenças intercorrentes, e estado nutricional.2,10 A quantia dada como um bolus depende principalmente da medida de glicose no sangue e da quantia de carboidrato na próxima refeição. A maioria dos pacientes usarão razões de insulina-carboidrato (RICs) para descobrir sua dose de insulina (p. ex.: uma RIC de 1:10 significa 1 unidade de insulina para cada 10g de carboidrato na refeição). Usando este protocolo, se alguém está prestes a comer uma refeição que contenha 40g de carboidrato e sua RIC é de 1:10, ele(a) deve precisar de 4 unidades de insulina de ação rápida. O fator de sensibilidade à insulina (FSI) refere-se a quanto o açúcar no sangue vai cair em resposta a 1 unidade de insulina; por exemplo, um FSI de 1:100 significa que se espera que 1 unidade de insulina reduza o nível de glicose em 100mg/dL. Usando o mesmo exemplo, se o nível de glicose no sangue é de 300mg/dL, uma dose de correção de 2 unidades de insulina de ação rápida seria dada para corrigir o nível de glicose no sangue para uma meta entre 80-120 mg/dL. A RIC será ajustada pela equipe de diabetes ao longo do tempo, com base em leituras pré- e pós-prandiais de glicose no sangue. O FSI será mais ou menos equivalente a 1800/(dose diária total de insulina) e será ajustado pela equipe de diabetes com base na resposta da glicose no sangue para doses de correção de insulina. Há medidores de glicose disponíveis com calculadoras embutidas, que ajudam a calcular o bolus de insulina para uma refeição. A equipe multidisciplinar desempenha um papel importante no manejo de longo prazo de crianças com diabetes. A equipe consiste de enfermeiro(a)s especialistas em diabetes e psicólogo(a)s para apoio em diagnóstico e titulação contínua de insulina em períodos desafiadores como a adolescência. Os regimes de injeção de múltiplas doses de insulina (IMD) são demonstrados na Tabela 2.
Tratamento com Bomba de Insulina
A bomba de insulina é um dispositivo programável a pilha/bateria que é usado continuamente junto ao corpo, e tem o tamanho de um pager. As bombas são externas e liberam insulina por meio de um cateter subcutâneo que deve ser trocado a cada 2 ou 3 dias. E uma bomba de tubo, o cateter vai se conectar à bomba via tubo de plástico, enquanto que, em uma bomba de adesivo, a bomba, incluindo o cateter subcutâneo, é colada na pele. Uma bomba de adesivo tem um conjunto manual separado para operar a bomba. Exemplos comuns de bombas de tubo incluem a Medtronic 640G (disponível separadamente ou com monitoramento contínuo de glicose) e a AccuChek Insight. A Omnipod é um exemplo de bomba de adesivo.
As bombas de insulina contêm um reservatório apenas de insulina de ação rápida. A bomba vai liberar a insulina em segundo plano como uma taxa de infusão contínua (“taxa basal” ou “insulina basal”); isso substitui os regimes de IMD de longa duração. Os bolus são liberados ao se apertar um botão, no horário das refeições e em outros momentos de hiperglicemia, para corrigir níveis altos de glicose no sangue. A taxa basal também pode ser ajustada pelo paciente para cobrir diferentes atividades diurnas bem como questões como o “fenômeno do alvorecer” (o aumento nos níveis matutinos de glicose no sangue causado por um aumento de hormônios contrarreguladores).11,12

Tabela 2. Exemplos de regimes de injeção de múltiplas doses (IMD)
A taxa basal normalmente corresponde a aproximadamente 30% a 50% dos requisitos diários de insulina. Como a bomba contém apenas insulina de ação rápida, a bomba nunca deve ser desconectada, pois os níveis de glicose podem subir rapidamente.
Semelhante a alguns medidores de glicose no sangue, as bombas de insulina têm calculadoras embutidas com RCIs e FSI. O(a) paciente insere na bomba o seu nível de glicose no sangue e a quantidade de carboidratos, em gramas.
O Instituto Nacional de Excelência em Saúde e Cuidado (NICE, na sigla em inglês), do Reino Unido, recomenda usar bombas de insulina em crianças > 12 anos cuja diabetes não é bem controlada com regimes de IDM (HbA1c > 8,5% ou 69 mmol/mol) ou que tenham episódios frequentes e imprevisíveis de hipoglicemia que afetam sua qualidade de vida. Crianças < 12 anos podem ser consideradas para terapia com bombas se a IDM não for considerada apropriada.13
Monitoramento de Glicose
Monitores contínuos de glicose (sensores) medem a glicose intersticial a cada 3 ou 5 minutos. Há um atraso de cerca de 5 minutos entre as mudanças na glicose do sangue e o resultado da glicose no fluido intersticial. Pode-se usar um sensor com um regime de bomba ou de IDM. As leituras do sensor tornam-se menos confiáveis nos extremos de glicose no sangue, particularmente em leituras baixas de glicose. No período perioperatório, recomenda-se que a glicose capilar seja medida usando-se um medidor eletrônico de glicose no sangue, por causa das mudanças no equilíbrio de fluidos, da perfusão e do controle glicêmico.14 Algumas bombas de insulina tem um recurso (preditivo) de suspensão com glicose baixa, em que a bomba de insulina vai parar de administrar insulina se o sensor prever que a glicose vai atingir um certo nível baixo nos minutos seguintes, e retomará a liberação de insulina quando o sensor detectar um aumento nos níveis de glicose. Esse recurso é preditivo porque examina a taxa de mudança dos níveis de glicose e extrapola a curva. No futuro, recursos adicionais podem ficar disponíveis, como a habilidade da bomba em aumentar a liberação de insulina em resposta a leituras altas do sensor de glicose.
Complicações da Terapia de Bomba de Insulina
O(A) anestesista deve estar ciente das complicações raras mas específicas da terapia com bomba de insulina que podem ocorrer no período perioperatório. Tais complicações podem estar relacionadas ao cateter, ao(à) paciente, e à bomba. Problemas relacionados ao cateter incluem deslocamento, bloqueio ou torção. Os problemas do(a) paciente incluem reações e infecções no local do cateter. A própria bomba também pode funcionar mal, e isso é mais provável se estiver em um campo cirúrgico.11 Uma alternativa seria usar uma escala de administração em vez da bomba, caso haja preocupações.
É importante que o anestesista considere a compatibilidade da bomba de insulina com outros equipamentos médicos.12 Isso é demonstrado na Tabela 3.

Tabela 3. Compatibilidade de Bombas de Insulina com Diferentes Tipos de Equipamentos Médicos

Figura 1. Prática comum para tempos de jejum para cirurgias no Reino Unido.
Manejo da DM Tipo 2
Crianças com DM tipo 2 são manejadas de maneira semelhante a adultos. O manejo inicial se faz por meio de fatores de estilo de vida da dieta, perda de peso e aumento de exercícios. As medidas de HbA1c são usadas para avaliar o bom controle, com a meta de um nível de HbA1c < 7%. Caso isso não seja alcançado, os hipoglicêmicos são adicionados, com a metformina na primeira linha. A maioria do(a)s pacientes acabarão precisando de terapia de insulina em suas vidas.15
MANEJO PERIOPERATÓRIO DA DM
A combinação de jejum, estresse emocional e estresse cirúrgico pode tornar o controle glicêmico difícil no período perioperatório. Portanto, as diretrizes do NICE recomendam o manejo perioperatório multidisciplinar da criança com diabetes, envolvendo a equipe cirúrgica, os anestesistas, pessoal de enfermaria e a equipe de diabetes. Além disso, centros que fornecem cirurgia pediátrica para crianças com diabetes devem ter protocolos escritos sobre o manejo perioperatório. Cirurgia eletiva deve ser considerada apenas quando HbA1c é <8,5% (69 mmol/mol). Crianças com diabetes devem idealmente ser colocadas na frente na lista, para reduzir o período de jejum.
As diretrizes normais de jejum aplicam-se a crianças com DM, com o fator-chave sendo manter o jejum pelo período mais curto possível. V. Figura 1.
O manejo perioperatório deve considerar o tipo de cirurgia, horário do dia da cirurgia, duração esperada do jejum e o regime atual de tratamento da diabetes.
O monitoramento de glicose no sangue capilar deve idealmente ser realizado a cada 30-60 minutos durante o período perioperatório até que a ingestão oral normal e o regime de insulina sejam retomados. O controle menos rígido da glicose no sangue é particularmente importante em crianças nas quais o risco de hipoglicemia é maior por causa de reservas mais baixas de glicogênio. A hiperglicemia pode aumentar a infecção pós-operativamente, bem como o tempo de permanência no hospital. Os níveis recomendados de glicose no sangue perioperatória são de 90-200mg/dL. V. Figura 2.
Há diferentes maneiras de se modificar o regime de tratamento de uma criança antes da cirurgia. Um método é classificar o tipo de cirurgia como maior ou menor. Isso depende da duração da operação e do período de jejum. Cirurgia menores têm uma duração esperada <30 minutos, e apenas uma refeição perdida. Cirurgias maiores têm duração esperada >30 minutos com mais de uma refeição perdida, na qual a ingestão oral normal não será retomada com a refeição seguinte. Embora seja um método útil, nem todos os casos vão se encaixar perfeitamente nessas categorias, por exemplo, cirurgia ambulatorial que dure mais de 30 minutos com apenas 1 refeição perdida, necessitando que julgamento clínico seja empregado em casos individuais.
Manejo Perioperatório de Crianças com DM Tipo 1 em Cirurgia Eletiva Menores2,14
Os princípios para o manejo de crianças com DM tipo 1 submetidas a cirurgia eletiva menor é continuar a insulina de longa ação independentemente de a cirurgia ser pela manhã ou à tarde. O componente de ação curta é alterado dependendo de a cirurgia ser pela manhã (omitido ou adiado até depois da cirurgia e que a criança tenha retomado a ingestão oral normal) ou à tarde (quando a criança tem permissão para tomar café da manhã, que pode ser dado como de costume).
Para crianças tomando insulina pré-misturada (insulinas de ação rápida e de ação intermediária são misturadas), a dose matutina é omitida ou adiada para cirurgia matutina. Para cirurgia vespertina, metade da dose do componente de ação rápida da insulina pré-misturada deve ser administrada pela manhã como insulina de ação rápida apenas.
Um exemplo é se a dose habitual do(a) paciente for 10 unidades de Novomix 30 ou Humulin M3, então o componente habitual de ação rápida é 3/10 x 10 = 3 unidades de insulina de ação rápida (p. ex.: insulina asparte [NovoRapid], Humalog lispro [Humalog], glulisina [Apidra]); metade = 1,5 unidade de insulina de ação rápida apenas. A dose de insulina intermediária é omitida. V. Figura 3.

Figura 2. Faixa da meta de glicose perioperatória no sangue.
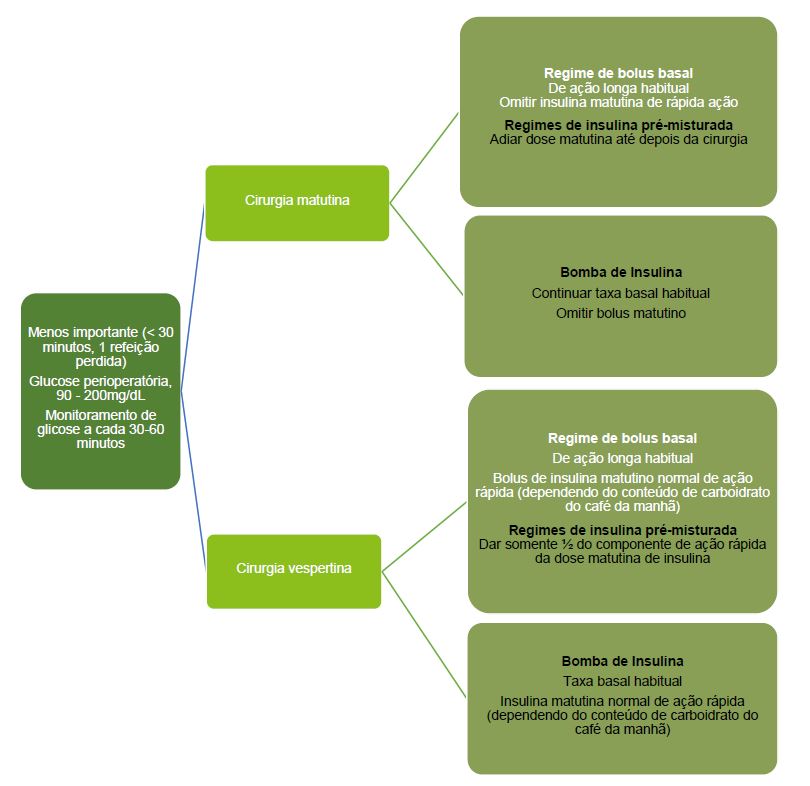
Figura 3. Manejo perioperatório de crianças com DM tipo 1 em cirurgia eletiva menos importante.
Manejo Perioperatório de Crianças com DM Tipo 1 em Cirurgia Eletiva Maior.
O princípio para crianças com regimes de bolus basal submetidas a cirurgia eletiva maior pela manhã é ou dar entrada na noite anterior ou no dia da cirurgia (dependendo da instituição), continuar a insulina de ação longa, omitir a insulina de ação rápida pela manhã, e iniciar fluidos intravenosos (IV) e uma escala de admnistração de insulina IV.14

Tabela 4. Medidas de Glicose no Sangue e Taxas Correspondentes de Escala Móvel de Insulina
Pacientes em terapia de bomba de insulina devem ter a taxa basal habitual de ação rápida continuada até 3 a 6 horas antes da cirurgia, ocasião em que devem mudar para fluidos IV e uma escala de administração IV, com o bolus matutino de insulina de ação rápida omitido. Regimes de insulina pré-misturada devem omitir a dose matutina de insulina. Os fluidos IV e a escala de administração IV devem ser iniciados quando da entrada hospitalar.
Pacientes em um regime de bolus basal com cirurgia marcada para a tarde devem continuar sua insulina de longa ação, tomar sua dose habitual de insulina de ação rápida pela manhã (dependendo do conteúdo de carboidrato), e iniciar fluidos IV e uma escala de administração de insulina IV quando da entrada hospitalar. Pacientes em terapia de bomba de insulina devem continuar a taxa basal habitual de ação rápida até 3 a 6 horas antes da cirurgia, ocasião em que devem mudar para fluidos IV e uma escala de administração IV. Deve-se dar o bolus matutino de ação rápida habitual. Regimes pré-misturados devem dar metade da dose matutina de insulina de ação rápida. A dose de insulina intermediária é omitida, e os fluidos IV e a escala de administração V são iniciadas quando da entrada hospitalar. V. Figura 4.
Escala de Administração de Insulina14
Dilua 50 unidades de insulina solúvel (Actrapid) em 50 ml de solução salina 0,9% (1 U/ml).
Monitore a glicose no sangue a cada 30 a 60 minutos perioperatoriamente até que a criança seja capaz de retomar a ingestão oral normal.
Se a glicose no sangue estiver <72mg/dL, interrompa a escala IV por 10 a 15 minutos. Dê 2 ml/kg de dextrose 10% IV e verifique novamente a glicose no sangue em 15 minutos. Reinicie a escala móvel IV quando a glicose no sangue estiver >72mg/dL.
O fluido de manutenção mais usado é solução salina 0,45% e dextrose 5%. Se o sódio estiver baixo, pode-se usar 0,9% de solução salina. Quando o açúcar no sangue estiver <72 mg/dL, use dextrose 10% IV. Quando o açúcar no sangue estiver alto, ainda se deve incluir dextrose 5%, mas a taxa de insulina deve ser aumentada, conforme a Tabela 4. Os eletrólitos devem ser monitorados quando a escala estiver em andamento, e 20 mmol/l de cloreto de potássio devem ser incluídos nos fluidos de manutenção. Isso pode ser aumentado de os níveis de potássio dimunuírem.
A Tabela 4 mostra como ajustar a escala com base nas medidas de glicose no sangue.
Manejo Perioperatório de Crianças com DM Tipo 2 em Cirurgia Eletiva2,14
O princípio do manejo de crianças com DM tipo 2 submetida a cirurgia eletiva é interromper os hipoglicêmicos orais no dia da cirurgia, além da metformina, que deve ser descontinuada 24 h antes da operação. V. Figura 5.
Manejo Perioperatório de Crianças em Cirurgia de Emergência2,14
Crianças com diabetes que se apresentem para cirurgia de emergência devem ter as cetonas em seu sangue medidas, bem como o gás sanguíneo venoso, para se verificar a cetoacidose diabética (CAD). As diretrizes para CAD devem ser seguidas se os critérios diagnósticos forem preenchidos. Para crianças que não estejam em CAD, fluidos e uma escala de administração devem ser iniciados.16 V. Figura 6.
Manejo Perioperatório da Hipoglicemia2,14
A maioria das equipes de diabetes definem um nível de glicose no sangue <72mg/dL como hipoglicemia. Todavia, é mais seguro usar um limiar de 90mg/dL no período perioperatório. Níveis de glicose <90mg/dL podem ser tratados com glicose oral ou IV. Para crianças sem acesso IV, deve-se dar glucagon intramuscular. Os níveis de glicose no sangue devem ser verificados novamente após 15 minutos. V. Figura 7.
Manejo Perioperatório da Hiperglicemia2,14
Crianças com hiperglicemia (glicose no sangue >252mg/dL) devem ter as cetonas do sangue verificadas para se descartar CAD. A maioria das famílias e hospitais tem medidores de cetona nos pontos de atendimento. Isso deve ser manejado conforme as diretrizes para CAD se os critérios diagnósticos forem preenchidos. Para crianças que não estejam em CAD, fluidos e insulina IV devem ser iniciados conforme a escala móvel. V. Figura 8.
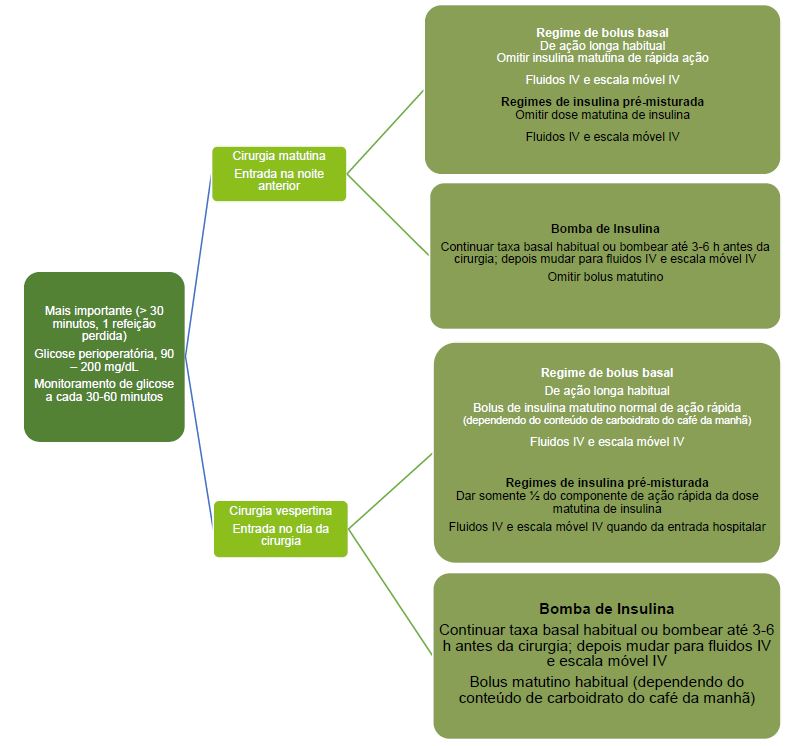
Figura 4. Manejo perioperatório de crianças com DM tipo 1 em cirurgia eletiva de maior porte.
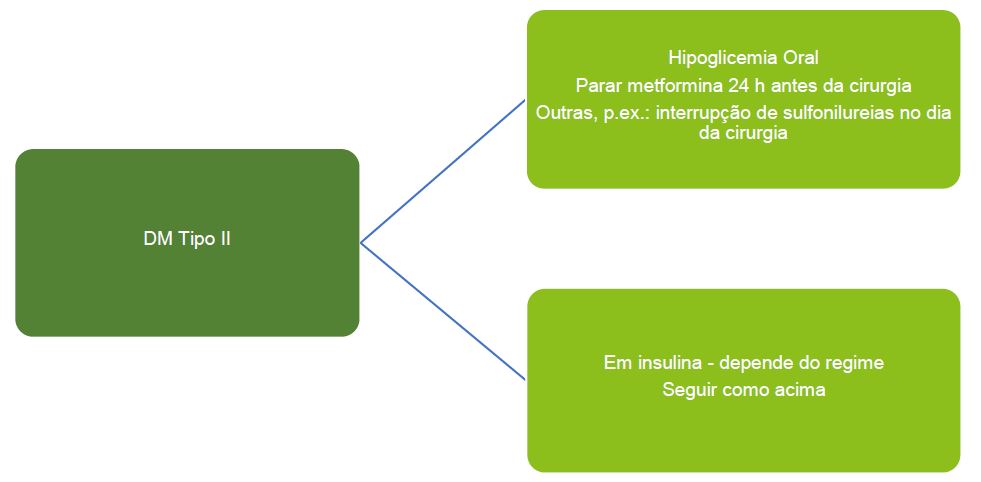
Figura 5. Manejo perioperatório de crianças com DM tipo 2 em cirurgia eletiva.
O Conceito de Sistemas de Circuito Aberto e Fechado
Um sistema de circuito aberto é aquele em que o(a) paciente aplica a insulina a ela(a) mesmo(a) em diferentes horários do dia. Os dois principais sistemas de circuito aberto são a IDM e a terapia com bomba de insulina (como discutido anteriormente).
Pesquisas futuras para melhorar o controle glicêmico e a liberação de insulina estão investigando sistemas de circuito fechado. Um sistema de circuito fechado é aquele em que a aplicação de insulina e o controle glicêmico do sangue ocorrem com mínimo envolvimento do(a) paciente. Idealmente, um dispositivo externo não deve ser necessário, e a exigência de injeções deve ser reduzido ou eliminado completamente.
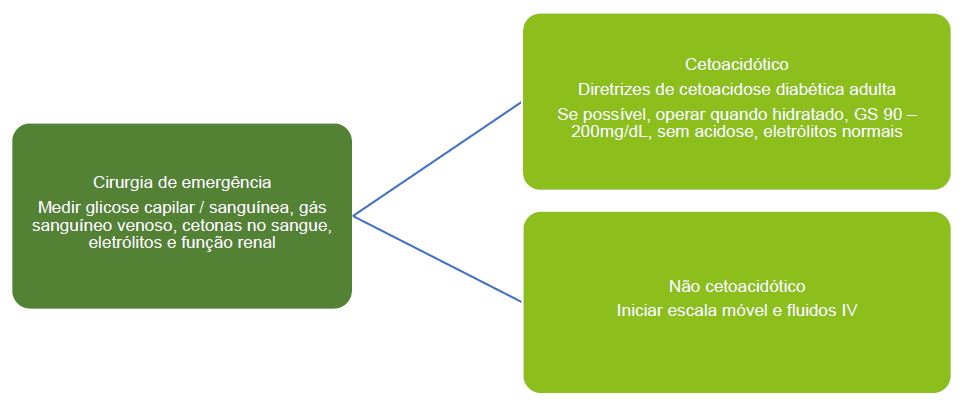
Figura 6. Manejo perioperatório de crianças em cirurgia de emergência.
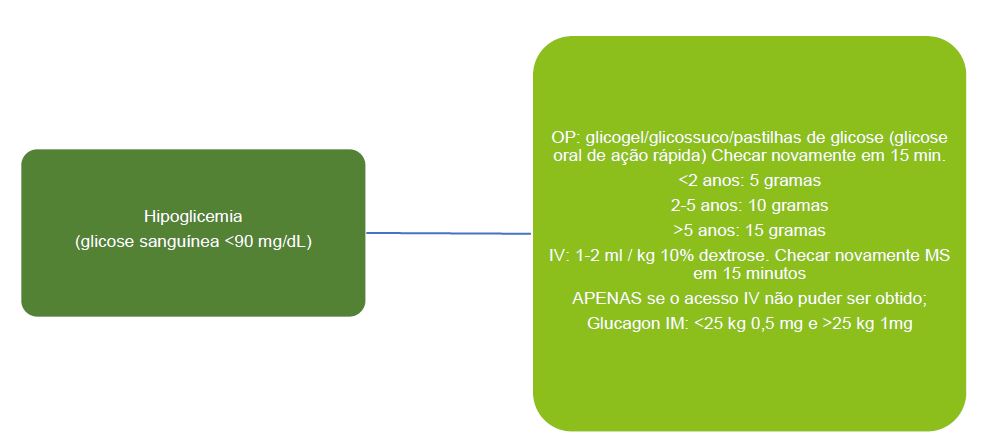
Figura 7. Manejo perioperatório da hipoglicemia.
Exemplos de métodos que poderiam criar um sistema de circuito fechado incluem transplante pancreático, restauração da secreção de insulina no pâncreas original, transplante de células de ilhota encapsuladas de um pâncreas de doador saudável, ou a criação de um “pâncreas artificial”. Um pâncreas artificial é baseado em algoritmos e inclui um sensor de glicose abaixo da pele e uma conexão sem fio à bomba de insulina.17-19
As pesquisas estão atualmente em andamento nessa área.
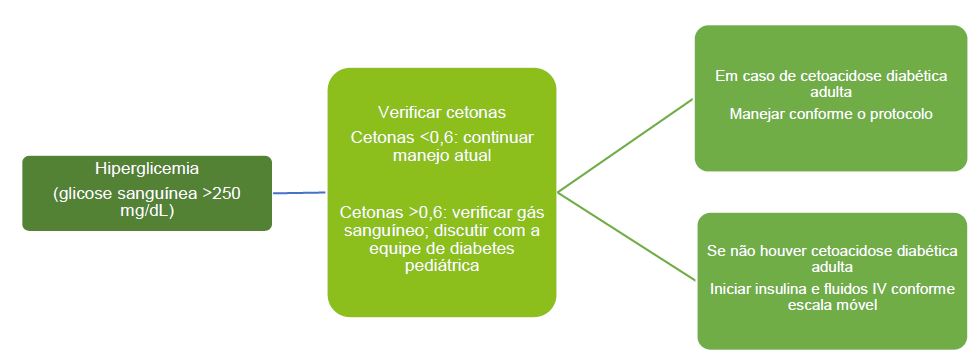
Figura 8. Manejo perioperatório da hiperglicemia
RESUMO
A DM é o transtorno metabólico mais comum em crianças, e sua incidência está aumentando. O período perioperatório é um momento desafiador, com o potencial para perturbações do controle glicêmico. O anestesista é parte importante da equipe multidisciplinar envolvida na otimização do manejo da diabetes por volta do momento da cirurgia, com um plano individualizado dependendo do tipo de cirurgia, regime de tratamento da diabetes, e comorbidades médicas. A meta é permitir que a ingestão oral normal e o manejo da diabetes sejam retomados o mais rápido possível pós-operatoriamente. Deve-se reconhecer que as recomendações acima são ideais e que podem nem sempre ser possíveis em ambientes com menos recursos, por exemplo, considerando as dificuldades em se armazenar insulina em refrigeradores e a disponibilidade de equipamentos requeridos para facilitar o monitoramento frequente da glicose no sangue.
REFERÊNCIAS
- Werret GC. Anaesthesia and Diabetes Mellitus. ATOTW archive. 2006. resources.wfsahq.org/components/com_virtual_library/ media/a0196f16bc99e3db22b62f10c7b3dfc1-96f858d8911c650454abd5d6426edd9a-34-Anaesthesia-and-diabetes-mellitus.pdf
- Tjen C, Wilkinson K. Perioperative care of children and young people with diabetes. BJA Education. 2016;16(4):124-129.
- International Diabetes Federation. Diabetes Atlas. 6th ed. http://www.idf.org/sites/default/files/ EN_6E_Atlas_Full_0.pdf. Published 2013. Accessed January 18, 2018.
- National Paediatric Diabetes Audit, Royal College of Paediatrics and Child Health. National Paediatric Diabetes Audit 201516. https://www.rcpch.ac.uk/sites/default/files/NPDA_2015-16_audit_report.pdf. Published February 2017. Accessed January 18, 2018
- Lamb W. Paediatric type I diabetes mellitus. Medscape. Published 2017. Accessed January 18, 2018. https://emedicine. medscape.com/article/919999-overview
- Barrett T. Type 2 diabetes mellitus. Incidence, management and prognosis. Paediatr Child Health. 2017;27(4):166-70.
- Pozzo A. Paediatric type 2 diabetes mellitus. Medscape. 2017. (accessed 18th January 2018). https://reference.medscape. com/article/925700-overview
- National Institute for Health and Care Excellence. Diabetes (type 1 and 2) in children and young people: diagnosis and management. www.nice.org.uk/guidance/ng18. Published 2015. Accessed January 18, 2018.
- World Health Organisation. Definition and Diagnosis of Diabetes Mellitus and Intermediate Hyperglycaemia. Report of the WHO/IDF consultation. Published 2006. https://www.who.int/diabetes/publications/Definition%20and%20diagnosis%20of%20diabetes_new.pdf.
- Danne T, Bangstad H-J, Deeb L, et al. Insulin treatment in children and adolescents with diabetes. Pediatr Diabetes. 2014;15(suppl 20):115-134.
- National Institute for Health and Care Excellence. Continuous subcutaneous insulin infusion for the treatment of diabetes mellitus. The technology. https://www.nice.org.uk/guidance/ta151/chapter/3-The-technology. Accessed March 16, 2018.
- Partridge H, Perkins B, Mathieu S, et al. Clinical recommendations in the management of the patient with type I diabetes on insulin pump therapy in the peri-operative period: a primer for the anaesthetist. Br J Anaesth. 2016;116:18-26.
- National Institute for Health and Care Excellence. Continuous subcutaneous insulin infusion for the treatment of diabetes mellitus. www.nice.org.uk/guidance/TA151/chapter/1-guidance. Published 2008. Accessed March 14, 2018.
- Agwu C, Ng S, Edge J et al. Care of children under 18 years with diabetes mellitus undergoing surgery. Association of Children’s Diabetes Clinicians. 2017;1-11. www.a-c-d-c.org/wp-content/uploads/2012/08/Care-of-children-under-18-yearswith-Diabetes-Mellitus-undergoing-Surgery-1.pdf
- Pozzo A. Paediatric type 2 diabetes mellitus treatment and management. Medscape. Published 2017. Accessed March 14, 2018. https://reference.medscape.com/article/925700-treatment
- National Institute for Health and Care Excellence. Diabetic ketoacidosis in children and young people. http://pathways.nice.org.uk/pathways/diabetes-in-children-and-young-people/diabetic-ketoacidosis-in-children-and-young-people. Accessed September 6, 2018.
- Farmer T, Edgar T, Pepper N. The future of open and closed loop insulin delivery for diabetes mellitus. J Pharmacol. 2008;60(1):1-13.
- Diabetes UK. Research spotlight – the artificial pancreas. https://www.diabetes.org.uk/research/research-round-up/re search-spotlight/research-spotlight-the-artificial-pancreas. Accessed March 16, 2018.
- Thabit H, Tauschmann M, Allen, JM, et al. Home use of an artificial beta cell in type 1 diabetes. N Engl J Med. 2015;373(22):2129-2140.



