Covid-19
PUNTOS CLAVES
- La neumonía asociada al ventilador (NAV) es una causa significativa de morbimortalidad en pacientes críticamente enfermos.
- El factor de riesgo clave para el desarrollo de NAV es un tubo endotraqueal o un traqueostomo con manguito inflado, los cuales interfieren ambos con la anatomía y fisiología normal del tracto respiratorio.
- La NAV ocurre solo en pacientes quienes han sido intubados y sometidos a ventilación mecánica (VM) mas de 48 horas. El riesgo de NAV se incrementa con VM prolongada.
- La aparición temprana de NAV es usualmente causada por bacterias adquiridas de la comunidad sensibles a antibióticos. La NAV que se desarrolla mas de 5 días después del inicio de la VM tiene una probabilidad incrementada de ser causada por una bacteria resistente a múltiples drogas.
- Los paquetes de prevención de NAV proporcionan un método efectivo de reducción de las tasas individuales de NAV de las unidades de cuidados intensivos.
- El tratamiento se basa en una alta sospecha clínica, diagnóstico temprano e inicio de antibióticos adecuados a los resultados de las muestras microbiológicas.
INTRODUCCION
La neumonía asociada al ventilador (NAV) es una causa significativa de morbimortalidad en pacientes críticamente enfermos dentro de las unidades de cuidados intensivos (UCI) quienes son sometidos a ventilación mecánica (VM) a través de un tubo endotraqueal (TET) o traqueostomía. El diagnóstico temprano y la adopción de prácticas conocidas para prevenir la NAV pueden reducir la mortalidad y disminuir el desarrollo de organismos resistentes a múltiples drogas.1 En este artículo nosotros discutiremos la incidencia, sistemas de puntuación, fisiopatología, prevención, factores de riesgo, diagnóstico y tratamiento de la NAV.
Definición
La NAV es un tipo de neumonía adquirida en el hospital que ocurre mas de 48 horas después de la intubación endotraqueal. Puede ser adicionalmente clasificada como de aparición temprana (dentro de las primeras 96 horas de VM) y de aparición tardía (mas de 96 horas después de iniciada la VM), la cual es mas comúnmente atribuible a patógenos resistentes a múltiples drogas.2
Incidencia
La NAV es común en pacientes críticos y es responsable de cerca de la mitad de todos los antibióticos dados a los pacientes en UCIs.3 Las cifras dadas por el Consorcio Internacional para el Control de la Infección Nosocomial sugiere que la tasa general de NAV es 13,6 por 1000 días de ventilador.4 Sin embargo, la tasa individual varía de acuerdo al grupo de pacientes, factores de riesgo y entorno del hospital. El tiempo promedio que se toma desarrollar la NAV desde el inicio de la VM es alrededor de 5 a 7 días, con una tasa de mortalidad referida entre 24% y 76%.4
Una prueba online está disponible para Educación Médica Continua (EMC) auto-dirigida. Se estima que toma 1 hora realizarla. Por favor registre el tiempo invertido y repórtelo a su ente acreditador si usted desea reclamar puntos de EMC. Se otorgará un certificado al pasar la prueba. Por favor refiérase a la política de acreditación aquí.

Tabla 1. Factores de riesgo para el desarrollo de Neumonía Asociada al Ventilador6
FISIOPATOLOGIA
La clave para el desarrollo de la NAV es la presencia de un TET o traqueostomía, los cuales interfieren con la anatomía y fisiología normales del tracto respiratorio, específicamente los mecanismos funcionales envueltos en la eliminación de secreciones (tos y acción mucociliar).5 Los pacientes intubados tienen un nivel de conciencia reducido que compromete la eliminación voluntaria de secreciones, las cuales pueden entonces acumularse en la orofaringe.4 Esto conlleva a macroaspiración y microaspiración de secreciones orofaríngeas contaminadas que son ricas en patógenos peligrosos.
La flora oral normal comienza a proliferar y son capaces de viajar a lo largo del tubo endotraqueal, formando una película biológica resistente a antibióticos la cual eventualmente alcanza las vías aéreas inferiores.5 Los pacientes críticamente enfermos exhiben una capacidad deteriorada de suministrar una respuesta inmune a estos patógenos, conduciendo al desarrollo de una neumonía.2 La presencia de factores predisponentes adicionales tales como edema pulmonar en estos pacientes pueden acelerar el proceso también4 (ver tabla 1)
La NAV de aparición temprana, que ocurre dentro de los primeros 4 días de VM, es causada usualmente por bacterias adquiridas de la comunidad sensibles a antibióticos tales como Hemofilos y Estreptococos. La NAV que se desarrolla mas de 5 días después de la iniciación de la VM es usualmente causada por bacterias resistentes a múltiples drogas tales como la Pseudomona Aeruginosa.4 La tabla 2 resalta algunos de los factores de riesgo mas comunes para el desarrollo de un patógeno resistente a múltiples drogas.6
PREVENCION
La NAV prolonga la estadía en la UCI, incrementando de este modo el costo del manejo del paciente.4 Esto hace entonces la prevención de la NAV una prioridad en el manejo de los pacientes críticamente enfermos. Las medidas preventivas básicas incluyen minimizar el tiempo en un ventilador a través de la implementación de un protocolo de destete temprano con interrupciones regulares de la sedación y el evitar los cambios de circuitos respiratorios de rutina o programados.7
Una posición semi-acostada apropiada, levantando la cabecera de la cama de 30 a 45 grados, reduce la incidencia de microaspiración de contenido gástrico cuando se compara con pacientes cuidados en una posición supina.7 La profilaxis de la úlcera de estrés eleva el pH gástrico, lo cual va en detrimento de la protección inmunológica innata suministrada por el ácido gástrico. Se recomienda suspender la profilaxis de la úlcera de estrés en pacientes de riesgo bajo (aquellos queabsorben alimentos sin una historia de sangrado gastrointestinal).
Se ha demostrado que los puertos de succión subglóticos reducen la incidencia de NAV y reducen significativamente el uso de antibióticos5 (Figura 1). Si se anticipa que un paciente será ventilado mecánicamente por mas de 72 horas, se debería considerar la inserción de un tubo con drenaje subglótico.
La microaspiración puede también ser reducida por el mantenimiento de la presión del manguito neumático del TET en 20 a 30 cm H2O y el uso de presión positiva al final de la espiración.5
Se ha estudiado la descontaminación del tracto digestivo como un método de reducir la incidencia de NAV por disminución de la colonización del tracto respiratorio superior. Los métodos usados incluyen antisépticos, tales como la clorhexidina en

Tabla 2. Factores de riesgo para Neumonía Asociada al Ventilador Resistente a Múltiples drogas(NAV)6
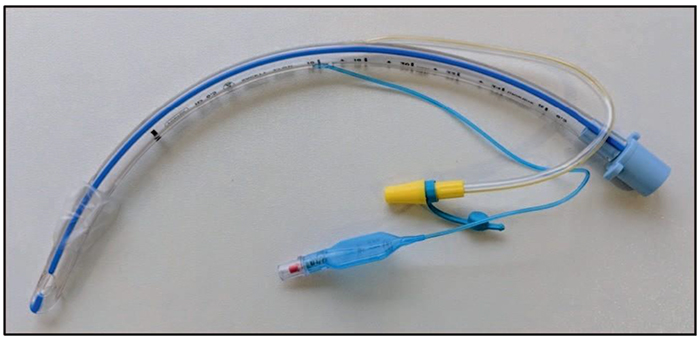
Figura 1. Tubo endotraqueal con la línea de succión subglótica amarilla (fabricado por Smiths Medical).
la orofaringe, y antibióticos no absorbibles, los cuales pueden ser aplicados en la orofaringe (descontaminación orofaríngea selectiva [DOS]), o administrados enteralmente (descontaminación selectiva del tracto digestivo [DSD]). El objetivo de este método es erradicar el transporte orofaríngeo o gastrointestinal de patógenos potencialmente peligrosos, tales como microorganismos aeróbicos gram-negativos y Estafilococo Aureus sensible a la meticilina. Se demostró que estos métodos reducen la mortalidad de los pacientes de UCI en hospitales con tasas bajas de resistencia a antibióticos.8 Sin embargo, la DSD nunca se ha convertido en una práctica regular, primordialmente debido a los temores sobre la ecología microbiana de largo plazo dentro de la UCI y la selección de organismos resistentes a drogas. LA DOS usando enjuagues bucales con clorhexidina se han convertido en una práctica regular, aunque mas recientemente ha sido restringida a prevención de NAV en pacientes que han sido sometidos a cirugía cardiaca. Revisiones recientes han demostrado una tendencia no-significativa a peores desenlaces en pacientes no cardiacos, aunque la razón para esto no es clara.9 Entonces, en pacientes no cardiacos, el cuidado bucal con clorhexidina se ha retirado de muchos protocolos de cuidado esencial.
El cuidado oral regular con higiene básica se orienta a reducir la colonización de la placa dental con gérmenes patógenos aeróbicos. Aunque hay evidencia limitada que apoye su uso, es improbable que cause daño. El uso de probióticos no ha conferido un impacto significativo en las tasas de mortalidad.7
Aunque no está establecido en la práctica clínica aún, los TET recubiertos de plata están mostrando resultados promisorios en reducir el riesgo relatico de desarrollo de NAV debido a las propiedades antibióticas de amplio espectro de la plata.7
Los protocolos de prevención de la NAV suministran un método efectivo para reducir las tasas de NAV de unidades individuales10 (Tabla 3).
DIAGNOSTICO
La NAV clásicamente se presenta con síntomas tales como fiebre, secreciones respiratorias purulentas, elevación de marcadores inflamatorios, dificultad respiratoria y empeoramiento de los parámetros respiratorios (volumen corriente reducido, ventilación minuto incrementada e hipoxia).4 Ciertos grupos de pacientes son vulnerables a organismos atípicos y
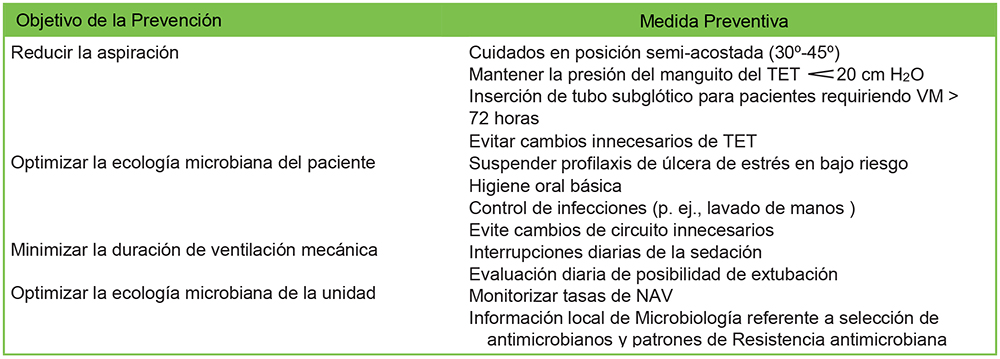
Tabla 3. Ejemplo de protocolo de prevención de Neumonía Asociada al Ventilador (NAV).
cada paciente demanda una evaluación diagnóstica completa para identificar el patógeno probable antes de iniciar los antibióticos.6 Cada paciente que exhibe signos de NAV debería tener una Rx de tórax y a aquellos que tienen cambios consistentes con infección se le debería enviar una muestra de las secreciones de su tracto respiratorio para tinción con Gram, cultivo y sensibilidad.10 Una Rx de tórax normal debería alertar al médico a considerar una alternativa diagnóstica. Sin embargo, un estudio demostró que solo en el 43% de los pacientes que tuvieron evidencia clínica y radiológica de NAV se confirmó que tenían un diagnóstico de NAV en el examen post-mortem.11
Previo al inicio de los antibióticos de amplio espectro se deben enviar muestras del tracto respiratorio a microbiología. Esto puede ser realizado bien sea por muestra no-broncoscópica (aspiración traqueobronquial o mini lavado broncoalveolar) o por muestra broncoscópica (lavado broncoalveolar o espécimen protegido de cepillado). Estas técnicas han sido comparadas y los resultados indican que el muestreo broncoscópico reduce la contaminación de las muestras del tracto respiratorio y suministra una representación mas adecuada de los patógenos probables; sin embargo, el impacto en la morbilidad y la mortalidad no ha sido demostrado.12 Esto puede permitir un régimen antibiótico mas dirigido y una disminución y cese de la antibiótico terapia mas temprana.
Los marcadores inflamatorios tales como procalcitonina y proteína C-reactiva pierden sensibilidad y especificidad para el diagnóstico de neumonía pero pueden ayudar a la toma de decisiones y reducir el sobre-uso de antibióticos.13 La investigación actual orientada a mejorar el diagnóstico de NAV incluye nuevos biomarcadores y tinción microbiana de fibra óptica.14, 15
Sistemas de Puntuación
Un sistema de puntuación descrito es la escala clínica de infección pulmonar (CPIS), la cual toma en cuenta un buen número de diferentes investigaciones.10

Tabla 4. Escala de Infección Clínica Pulmonar10
Una puntuación de CPIS de 6 o mas alta de un máximo de 12 puntos indica un probable diagnóstico de NAV.10 Han surgido preocupaciones, sin embargo, referentes a la validez diagnóstica del CPIS, con un meta-análisis reportando que la sensibilidad y especificidad del CPIS de 65% y 64% respectivamente.10 Además, hay una variabilidad significativa entre usuarios en el cálculo del CPIS a pesar de que aparentemente es de fácil de calcular.10
Los criterios de la Unión de Hospitales en Europa para Control de Infecciones a través de la Vigilancia (HELICS) descritos abajo son comúnmente usados para monitorizar las tasas de NAV.16 Un diagnostico de NAV se hace usando los criterios de HELICS cuando se han conseguido cada uno de los criterios radiológicos, sistémicos y pulmonares.

Tabla 5. La unión de hospitales en Europa para control de infecciones a través de la definición de vigilancia de NAV16
TRATAMIENTO
El tratamiento de la NAV descansa en el conocimiento de los patógenos comunes, los factores de riesgo del paciente (por ejemplo la inmunosupresión y la condición respiratoria subyacente) y los especímenes microbiológicos previos. El tratamiento empírico para la NAV debería incluir antibióticos con cobertura contra Pseudomona Aeruginosa, Estafilococo Aureus y bacilos gram-negativos, con antibióticos administrados en el momento oportuno.2 Se ha demostrado que el retraso el tratamiento y el fallo en seleccionar un régimen antibiótico adecuado de acuerdo con las políticas locales, resultan en tasas de mortalidad mas altas.1 Los antibióticos deberían ser disminuidos en forma segura una vez que los resultados microbiológicos estén disponibles, con la suspensión después de 7 días basada en la mejoría clínica y de los marcadores bioquímicos.6
RESUMEN
LA NAV sigue siendo un riesgo significativo para el paciente críticamente enfermo ventilado. El riesgo de desarrollar NAV puede ser mitigado por paquetes de prevención de NAV. No hay una única prueba diagnóstica para NAV por lo cual se usan los sistemas de puntuación basados en múltiples parámetros. Se requiere del diagnóstico oportuno para incitar el uso de los antibióticos apropiados para mejores pronósticos. Tanto los pacientes como las unidades están en riesgo de desarrollar organismos resistentes a múltiples drogas y entonces se requiere también una administración apropiada de los antibióticos. La investigación actual se orienta a mejorar el diagnóstico de NAV, lo cual puede conducir a una mayor certeza de cuando iniciar los antibióticos. Sin embargo, la prevención sigue siendo la mejor cura.
REFERENCIAS
- Muscedere JG, Shorr AF, Jiang X, et al. The adequacy and timely empiric antibiotic therapy for ventilator-associated pneumonia and blood stream infection: a meta-analysis. J Crit Care. 2012;27:322e7.
- Hunter JD. Ventilator associated pneumonia. Postgrad Med. 2006;82:172-178.
- Vincent JL, Bihari DJ, Suter PM, et al. The prevalence of nosocomial infection in intensive care units in Europe. Results of the European Prevalence of infection in Intensive Care (EPIC) Study. EPIC International Advisory Committee. JAMA. 1995;274:639-644.
- Charles P, Kali A, Easow JM, et al. Ventilator-associated pneumonia. Australas Med J. 2014;7(8):334-344.
- American Thoracic Society, Infectious Diseases Society of America. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med. 2005;171:388.
- Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016;63:e61.
- Klompas M, Branson R, Eichenwald ED, et al. Strategies to prevent ventilator-associated pneumonia in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol. 2014;35:915.
- Silvestri L, Van Saene HK, Casarin A, et al. Impact of selective decontamination of the digestive tract on carriage and infection due to gram-negative and gram-positive bacteria: a systematic review of randomised controlled trials. Anaesth Intensive Care. 2008;36:324.
- National UK guidelines for provision of intensive care version 1.1 (2016). https://www.ficm.ac.uk/standards-and-guide lines/gpics. Access Jun 15 2018.
- Kalanuria AA, Zai W, Mirski M. Ventilator-associated pneumonia in the ICU. Crit Care. 2014;18:208.
- Wunderink RG, Woldenberg LS, Zeiss J, et al. The radiologic diagnosis of autopsy-proven ventilator-associated pneumonia. Chest. 1992;101:458.
- Chastre J, Fagon JY. Ventilator-associated pneumonia. Am J Respir Crit Care Med. 2002;165(7):867-903.
- Seligman R, Meisner M, Lisboa TC, et al. Decreases in procalcitonin and C-reactive protein are strong predictors of survival in ventilator-associated pneumonia. Crit Care. 2006;10(5):R125.
- Mills B, Bradley M, Dhaliwal K. Optical imaging of bacterial infections. Clin Transl Imaging. 2016;4:163-174.
- Hellyer TP, Anderson NH, Parker J, et al. Effectiveness of biomarker-based exclusion of ventilator-acquired pneumonia to reduce antibiotic use (VAPrapid-2): study protocol for a randomised controlled trial. Trials. 2016 Jul 16;17(1):318.
- Browne E, Hellyer TP, Baudouin SV, et al. A national survey of the diagnosis and management of suspected ventilatorassociated pneumonia. BMJ Open Respiratory Research. 2014;1(1):e000066.



