Covid-19
PONTOS-CHAVE:
- A pneumonia associada à ventilação mecânica (PAV) é uma causa significativa de morbidade e mortalidade em pacientes gravemente doentes.
- O principal fator de risco para o desenvolvimento de PAV é um tubo endotraqueal com balonete ou traqueostomia, ambos interferindo na anatomia e fisiologia normais do trato respiratório.
- A PAV ocorre apenas em pacientes que foram entubados e passaram por ventilação mecânica (VM) por >48 horas. O risco de PAV aumenta com VM prolongada.
- O início precoce da PAV geralmente é causado por bactéria sensível a antibióticos adquirida na comunidade. A PAV que se desenvolve mais de 5 dias após o início da VM tem maior probabilidade de ser causada por bactérias resistentes a múltiplos medicamentos.
- Os conjuntos de prevenção da PAV fornecem um método eficiente pelo qual se reduz taxas individuais de PAV em UTIs.
- O tratamento se baseia em alta suspeição clínica, diagnóstico precoce, e início de antibióticos ajustados aos resultados dos espécimes microbiológicos.
INTRODUCÃO
A pneumonia associada à ventilação mecânica (PAV) é uma causa significativa de morbidade e mortalidade em pacientes gravemente doentes em unidades de terapia intensiva (UTIs) que passam por ventilação mecânica (MV) invasiva via tubo endotraqueal (TET) ou traqueostomia. O diagnóstico precoce e a adoção de práticas conhecidas na prevenção da PAV podem reduzir a mortalidade e diminuir o desenvolvimento de organismos resistentes a múltiplos medicamentos.¹ Neste artigo, discutiremos a incidência, sistemas de pontuação, patofisiologia, prevenção, fatores de risco, diagnóstico e tratamento da PAV.
Definição
A PAV é um tipo de pneumonia adquirida em hospitais que ocorre mais de 48 após e intubação endotraqueal. Ela pode ser classificada mais precisamente em início precoce (até as primeiras 96 horas da VM e início tardio (mais de 96 horas após o início da VM), que é mais comumente atribuída a patógenos resistentes a múltiplos medicamentos.
Incidência
A PAV é comum em pacientes em estado crítico, e é responsável por cerca de metade de todos os antibióticos dados a pacientes em UTIs.


Tabela 1. Fatores de Risco para o Desenvolvimento de Pneumonia Associada à Ventilação Mecânica 6
PATOFISIOLOGIA
A chave para o desenvolvimento da PAV é a presença de um TET ou traqueostomia, ambos os quais interferem com a anatomia e fisiologia normais do trato respiratório, especificamente os mecanismos envolvidos na limpeza de secreções (tosse e ação mucociliar).5 Pacientes intubados tem um nível de consciência reduzido que prejudica a limpeza voluntária de secreções, que podem então se acumular na orofaringe.4 Isso leva à macroaspiração e microaspiração de secreções contaminadas da orofaringe que são ricas em patógenos nocivos.
A flora bucal normal pode começar a se proliferar e é capaz de passar ao longo do tubo traqueal, formando um biofilme resistente a antibióticos que acaba chegando às vias aéreas inferiores.5 Pacientes em estado crítico exibem uma habilidade prejudicada de formar uma resposta imunológica a esses patógenos, levando ao desenvolvimento de uma pneumonia. A presença de fatores de pré-disposição adicionais, como edema pulmonar nesses pacientes, também pode acelerar o processo4 (v. Tabela 1).
A PAV de início precoce, que ocorre nos primeiros quatro dias da VM, geralmente é causada por bactérias sensíveis a antibióticos adquiridas na comunidade, como Haemophilus e Streptococcus. A PAV que se desenvolve mais de 5 dias após o início da MV geralmente é causada por bactérias resistentes a múltiplos medicamentos, como Pseudomonas aeruginosa.4 A Tabela 2 destaca alguns dos fatores de risco comuns para o desenvolvimento de um patógeno resistente a múltiplos medicamentos.6
PREVENÇÃO
A PAV prolonga a duração da permanência na UTI, dessa forma aumentando o custo de gestão de pacientes.4 Portanto, ela faz da prevenção da PAV uma prioridade na gestão de pacientes em estado crítico. Medidas preventivas básicas incluem minimizar o tempo excessivo no ventilador por meio da implementação de um protocolo de desmame precoce com intervalos de sedação regulares, e evitar trocas rotineiras ou programadas do circuito do ventilador.7
O posicionamento semirreclinado dos pacientes, com uma abordagem de 30°-40º com a cabeça elevada, reduz a incidência de microaspiração de conteúdo gástrico quando comparada a pacientes cuidados em uma posição supina.7 A profilaxia para úlcera de estresse eleva o pH gástrico, que é prejudicial à proteção imunológica inata fornecida pelo ácido gástrico. Recomenda-se interromper a profilaxia para úlcera de estresse em pacientes de baixo risco (pacientes que absorvem a alimentação sem um histórico de sangramento gastrointestinal).
Já foi demonstrado que as portas de sucção subglótica reduzem a incidência de PAV, e reduzem significativamente o uso de antibióticos5 (Figura 1). Caso se preveja que um paciente será ventilado mecanicamente por mais de 72 horas, deve-se considerar a inserção de um tubo com drenagem subglótica.
A microaspiração também pode ser reduzida por meio da manutenção de uma pressão do balonete de via aérea do tubo endotraqueal em 20 a 30 cm H2O e pelo uso de pressão expiratória final positiva.5
A descontaminação do trato digestivo foi estudada com um método de redução da incidência da PAV diminuindo a colonização do trato respiratório superior. Os métodos utilizados incluem antissépticos como a clorexidina na orofaringe e antibióticos não-absorvíveis, que podem ser aplicados à orofaringe (descontaminação seletiva da orofaringe [DSO]) ou administrado entericamente (descontaminação seletiva do trato digestivo [DSTD]).

Tabela 2. Fatores de Risco para Pneumonia Associada à Ventilação Mecânica (PAV) resistente a múltiplos medicamentos.6
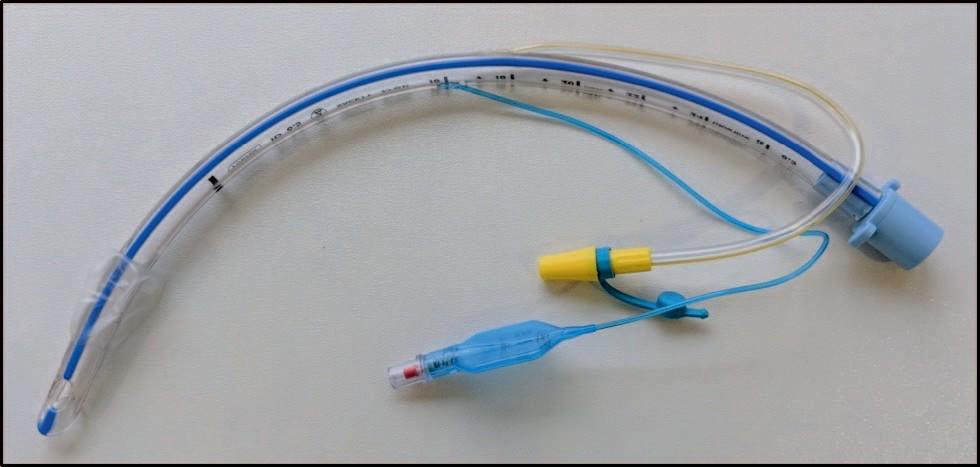
Figura 1. Tubo endotraqueal com linha de sucção subglótica amarela (fabricado por Smiths Medical).
O objetivo deste método é erradicar o carregamento orofaríngeo ou gastrointestinal de patógenos potencialmente nocivos, como micro-organismos aeróbicos gram-negativos e Staphylococcus aureus sensível a meticilina. Demonstrou-se que esses métodos reduzem a mortalidade de pacientes de UTI em hospitais com baixas taxas de resistência a antibióticos.8 Contudo, a DSTD nunca se tornou prática corrente, principalmente devido a preocupações com a ecologia microbiana de longo prazo dentro da UTI e à seleção de organismos resistentes a medicamentos. A DSO com uso de colutórios de clorexidina de fato se tornou uma prática rotineira, embora tenha se restringido mais recentemente a conjuntos de prevenção de PAV para pacientes que passaram por cirurgia cardíaca. Revisões recentes mostraram uma tendência insignificante em direção a resultados piores em pacientes não-cardíacos, embora a razão para isso não seja clara.9 Portanto, em pacientes não-cardíacos, o tratamento com colutório de clorexidina foi removido de muitos conjuntos de tratamento convencionais.
O cuidado bucal regular com metas de higiene básica visa a reduzir a colonização da placa bacteriana por patógenos aeróbicos. Embora haja evidências limitadas para o seu uso, é improvável que cause dano. O uso de probióticos não conferiu qualquer impacto significativo nas taxas de mortalidade.7
Embora ainda não estabelecidos na prática clínica, os TETs revestidos de prata estão mostrando resultados promissores na redução do risco relativo para o desenvolvimento de PAV devido às propriedades antibióticas de amplo espectro da prata.7
Os conjuntos de prevenção da PAV fornecem um método eficiente pelo qual se reduz taxas individuais de PAV em UTIs10 (Tabela 3).
DIAGNÓSTICO
A PAV classicamente se apresenta com sintomas como febre, secreções pulmonares purulentas, marcadores inflamatórios elevados, desconforto respiratório, e piora nos parâmetros respiratórios (volume corrente reduzido, aumento no volume-minuto, e hipóxia).4 Certos grupos de pacientes são vulneráveis a organismos atípicos e cada paciente exige uma avaliação diagnóstica completa para se identificar o provável patógeno antes de começar a administrar antibióticos.6

Tabela 3. Exemplos de Conjuntos de Prevenção de Pneumonia Associada à Ventilação Mecânica (PAV)

Tabela 4. A Pontuação Clínica de Infecção Pulmonar10
Todo paciente que exibir sinais de PAV deve ser submetido a um raio-X do tórax, e aqueles que exibirem mudanças consistentes com a infecção devem ter amostrar de secreções do tato respiratório enviadas para coloração Gram, cultura e sensibilidade.10 Um raio-X normal do tórax deve levar o clínico a considerar um diagnóstico alternativo. Contudo, um estudo mostrou que apenas 43% dos pacientes que tiveram evidências clínicas e radiográficas de PAV tiveram confirmado o diagnóstico de PAV nos exames pós-morte.11
Antes de iniciar antibióticos de amplo espectro, deve-se enviar amostras respiratórias do paciente para a microbiologia. Isso pode ser realizado tanto por amostragem não-broncoscópica (aspiração traqueobronquial ou minilavagem broncoalveolar) ou via amostragem broncoscópica (lavagem broncoalveolar ou escovado brônquico protegido). Essas técnicas foram comparadas, e os resultados indicam que a amostragem broncoscópica reduz a contaminação do trato respiratório de amostras e fornece uma representação mais precisa de prováveis patógenos; contudo, o impacto na morbidade ou mortalidade geral não foi demonstrado.12 Isso pode permitir um regime antibiótico mais direcionado e redução e cessação precoce da terapia antibiótica.
Marcadores inflamatórios como a procalcitonina e proteína C reativa não têm a sensibilidade e especificidade para o diagnóstico de pneumonia, mas podem ajudar a tomar decisões e reduzir o uso excessivo de antibióticos.13 Pesquisas atuais que visam a melhorar o diagnóstico da PAV incluem novos biomarcadores e coloração microbiana por fibra ótica.14,15
Sistemas de Pontuação
Um sistema de pontuação descrito é a pontuação clínica de infecção pulmonar (PCIP), que leva em consideração várias investigações diferentes.10

Tabela 5. Definição do programa HELICS para pneumonia associada à ventilação.16
Uma pontuação PCIP de 6 ou superior, de um máximo de 12, indica um provável diagnóstico de PAV.10 Contudo, houve certa preocupação quanto à validade do diagnóstico da PCIP, com uma meta-análise relatando a sensibilidade e especificidade para PCIP como 65% e 64% respectivamente.10 Além disso, há uma significativa variabilidade do usuário no cálculo da PCIP, apesar se ser um cálculo aparentemente simples.10
Os critérios do Programa HELICS (Ligação dos Hospitais Europeus para Controle de Infecções por meio de Vigilância) mostrados abaixo são comumente utilizados para se monitorar as taxas de PAV.16 Um diagnóstico de PAV é feito utilizando-se os critérios HELICS quando cada um dos critérios radiológicos, sistêmicos e pulmonares foram atingidos.
TRATAMENTO
O tratamento da PAV baseia-se no conhecimento de patógenos comuns, fatores de risco do paciente (por exemplo, imunossupressão e doença respiratória subjacente), e espécimes microbiológicos anteriores. Um tratamento empírico para PAV deve incluir antibióticos para se proteger contra Pseudomonas aeruginosa, Staphylococcus aureus e bacilos Gram-negativos, com antibióticos administrados em tempo hábil.2 Demonstrou-se que o atraso no tratamento e o fracasso em se selecionar um regime antibiótico adequado de acordo com a política local resultaram em taxas de mortalidade mais altas.1 Os Antibióticos devem ser descalonados com segurança logo que os resultados da microbiologia estiverem disponíveis, com cessação após 7 dias baseado em marcadores clínicos e bioquímicos melhorados.6
RESUMO
A PAV continua a ser um risco significativo para pacientes graves ventilados. O riso de desenvolvimento da PAV pode ser mitigado com conjuntos de prevenção de PAV. Não há um teste diagnóstico único para a PAV, e, portanto, são usados sistemas de pontuação baseados em múltiplos parâmetros. O diagnóstico feito em tempo hábil é necessário para a prescrição de antibióticos apropriados para resultados melhores. Tanto os pacientes quanto as unidades estão sob o risco de desenvolver organismos resistentes a múltiplos medicamentos e, portanto, também é necessária uma gestão antibiótica apropriada. As pesquisas atuais visam a melhorar os diagnósticos para PAV, o que pode levar a uma melhor certeza em relação a quando começar o tratamento com antibióticos. Contudo, a prevenção permanece sendo a melhor cura.
REFERÊNCIAS
- Muscedere JG, Shorr AF, Jiang X, et al. The adequacy and timely empiric antibiotic therapy for ventilator-associated pneumonia and blood stream infection: a meta-analysis. J Crit Care. 2012;27:322e7.
- Hunter JD. Ventilator associated pneumonia. Postgrad Med. 2006;82:172-178.
- Vincent JL, Bihari DJ, Suter PM, et al. The prevalence of nosocomial infection in intensive care units in Europe. Results of the European Prevalence of infection in Intensive Care (EPIC) Study. EPIC International Advisory Committee. JAMA. 1995;274:639-644.
- Charles P, Kali A, Easow JM, et al. Ventilator-associated pneumonia. Australas Med J. 2014;7(8):334-344.
- American Thoracic Society, Infectious Diseases Society of America. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med. 2005;171:388.
- Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016;63:e61.
- Klompas M, Branson R, Eichenwald ED, et al. Strategies to prevent ventilator-associated pneumonia in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol. 2014;35:915.
- Silvestri L, Van Saene HK, Casarin A, et al. Impact of selective decontamination of the digestive tract on carriage and infection due to gram-negative and gram-positive bacteria: a systematic review of randomised controlled trials. Anaesth Intensive Care. 2008;36:324.
- National UK guidelines for provision of intensive care version 1.1 (2016). https://www.ficm.ac.uk/standards-and-guide lines/gpics. Access Jun 15 2018.
- Kalanuria AA, Zai W, Mirski M. Ventilator-associated pneumonia in the ICU. Crit Care. 2014;18:208.
- Wunderink RG, Woldenberg LS, Zeiss J, et al. The radiologic diagnosis of autopsy-proven ventilator-associated pneumonia. Chest. 1992;101:458.
- Chastre J, Fagon JY. Ventilator-associated pneumonia. Am J Respir Crit Care Med. 2002;165(7):867-903.
- Seligman R, Meisner M, Lisboa TC, et al. Decreases in procalcitonin and C-reactive protein are strong predictors of survival in ventilator-associated pneumonia. Crit Care. 2006;10(5):R125.
- Mills B, Bradley M, Dhaliwal K. Optical imaging of bacterial infections. Clin Transl Imaging. 2016;4:163-174.
- Hellyer TP, Anderson NH, Parker J, et al. Effectiveness of biomarker-based exclusion of ventilator-acquired pneumonia to reduce antibiotic use (VAPrapid-2): study protocol for a randomised controlled trial. Trials. 2016 Jul 16;17(1):318.
- Browne E, Hellyer TP, Baudouin SV, et al. A national survey of the diagnosis and management of suspected ventilator- associated pneumonia. BMJ Open Respiratory Research. 2014;1(1):e000066.



