Obstetric Anaesthesia
INTRODUCCIÓN
La hemorragia obstétrica es una de las principales causas de morbilidad y mortalidad materna en todo el mundo (1). La incidencia y la gravedad de la hemorragia posparto (HPP) están aumentando; las tasas de HPP en Canadá aumentaron del 5,1% al 6,2% (un aumento del 22%) entre 2003 y 2010, mientras que la HPP que requirió una transfusión de sangre aumentó de 37 a 50,4 por 10 000 partos (un aumento del 37%) en comparación con el mismo periodo de tiempo(1,2).
El rescate de células intraoperatorias (ICS) ofrece una alternativa o una opción a la transfusión de sangre alogénica (donante) durante una hemorragia obstétrica y se recomienda en las pautas publicadas por la Asociación de Anestesistas de Gran Bretaña e Irlanda (AABGI), Asociación de anestesistas obstétricos (OAA) y el Instituto Nacional de Excelencia en Salud y Atención (NICE) en el Reino Unido (3,4).El ensayo aleatorizado de control del grupo SALVO encontró que el uso de rutina de ICS durante la cesárea (CS) no cambió significativamente la tasa de transfusión de sangre postoperatoria y la recuperación de los pacientes fue clínicamente similar (5). Sin embargo, en estudios donde el volumen promedio de sangre devuelto al paciente con ICS fue mayor (360 ml frente a 260 ml), aunque en una población de estudio más pequeña no aleatorizada, la hemoglobina postoperatoria fue mayor y la estancia hospitalaria más corta (5,6 ). Esto sugiere que la ICS puede ser más beneficiosa en mujeres con factores de riesgo de HPP durante la CS. En obstetricia, ICS ha demostrado ser seguro, beneficioso y rentable (5,7).
Este tutorial tiene como objetivo abordar las indicaciones, contraindicaciones, ventajas, desventajas, riesgos y principios de la ICS en obstetricia.
INDICACIONES PARA EL SALVADO CELULAR INTRAOPERATORIO
Las indicaciones para el ICS pueden ser liberales o restrictivas, pero deben ser consideradas para mujeres en riesgo de HPP durante la CS; El AAGBI, el Real Colegio de Obstetras y Ginecólogos y NICE definen esto como una pérdida de sangre estimada (EBL) superior a 1000 ml(3,4). El ICS se vuelve más rentable cuando existe una alta probabilidad de transfusión de glóbulos rojos, p. Ej. una CS repetida en el contexto de una placenta previa conocida, anemia preoperatoria grave o implantación placentaria anormal conocida (8). Las mujeres con una EBL de menos de 1000 ml pueden beneficiarse de la ICS, pero en menor medida (5,6). La Tabla 1, muestra ejemplos de cuándo se debe considerar el ICS, sin embargo, el uso varía según los protocolos y recursos locales. La gravedad de la HPP puede ser difícil de predecir, el beneficio potencial de la ICS aumenta a medida que se acumulan los factores de riesgo.
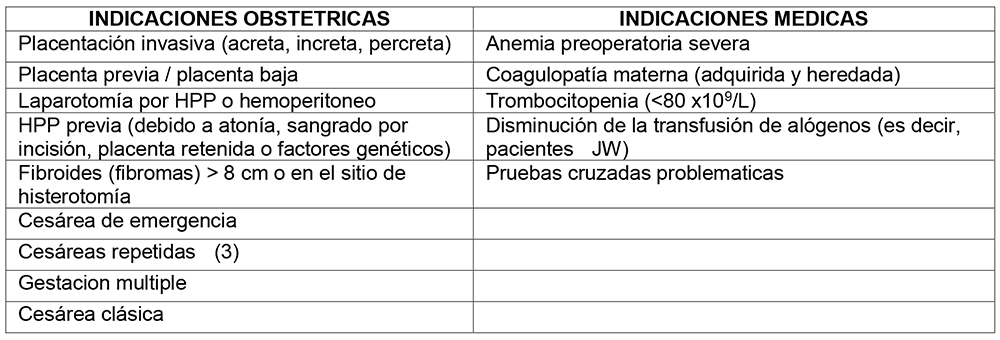
Tabla 1. Indicaciones obstétricas y médicas para el rescate de células intraoperatorias en la cesárea (HPP = hemorragia posparto, JW = testigo de Jehová).
CONTRAINDICACIONES PARA EL SALVADO CELULAR INTRAOPERATIVO
Contaminantes biológicos:
- Heces (Nota: la orina y el líquido amniótico son seguros)
- Agentes hemostáticos (Gelfoam ™, Avitene ™, Surgicel ™, Floseal ™, etc.)
- Medicación no apropiada para la administración intravenosa.
- Antecedentes de trombocitopenia inducida por heparina. (9)
- Malignidad
- Anemia de células falciformes homocigotas
La reinfusión de sangre recuperada en pacientes con neoplasia maligna presenta una preocupación teórica de diseminar células malignas, incluidas las neoplasias trofoblásticas gestacionales. La ICS se ha utilizado de manera segura en neoplasias urológicas, pero faltan datos completos de seguridad en obstetricia y otras neoplasias malignas (10).
No se recomienda la ICS en mujeres que son homocigotas para la anemia de células falciformes, ya que las condiciones hipóxicas en el reservorio de recogida pueden inducir la enfermedad en hasta el 50% de los eritrocitos recolectados (11). En escenarios que amenazan la vida, la ICS puede considerarse para pacientes que son heterocigotos. Si se requiere ICS para una mujer con enfermedad de células falciformes, se debe completar un frotis de sangre urgente en la sangre recolectada para determinar el grado de la enfermedad antes de la reinfusión (7,11).
VENTAJAS Y DESVENTAJAS DEL SALVADO CELULAR INTRAOPERATORIO
Ventajas
- No hay riesgo de reacciones de transfusión alogénicas o infecciones transmitidas por la sangre
- Evita los efectos inmunomoduladores de las transfusiones alogénicas y la infección nosocomial asociada. (12)
- Disponibilidad inmediata de sangre.
- Cuando la compatibilidad con la sangre es problemática (es decir, cuando hay anticuerpos presentes)
- Aceptado por algunos testigos de Jehová
- Administración segura junto con medicamentos (como uterotonicos y ácido tranexámico)
- La sangre recuperada es más fisiológica que la almacenada (consulte la Tabla 2 a continuación)
- La temperatura, 2,3-DPG, pH y potasio están más cerca de los valores maternos (7,13,14).
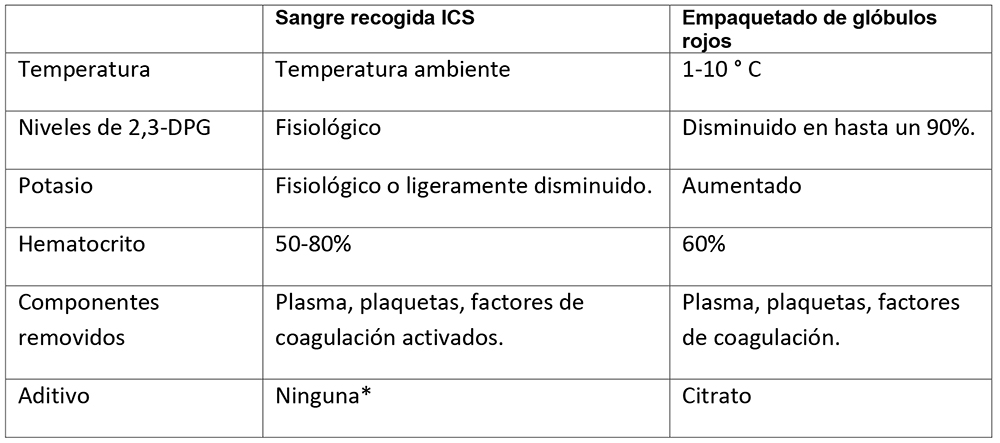
Tabla 2. Comparación de sangre recuperada y glóbulos rojos donados (ICS = rescate de células intraoperatorias, 2,3-DPG = 2,3-difosfoglicerato). * El lavado adecuado eliminará todas las cantidades de heparina (<10 unidades restantes) en sangre reinfundida (16)
Desventajas
- Costos elevados del dispositivo de recuperación de celdas y costo continuo de los desechables. Gastos de formación (entrenamiento).
- El tiempo de configuración puede limitar la utilidad durante una cesárea estadística.
- El volumen de sangre recuperada puede ser insuficiente y el paciente puede necesitar una transfusión de sangre alogénica además de la sangre recuperada
Los costos se pueden reducir configurando el circuito de recolección cuando se indique, y solamente utilizando el circuito de reinfusión cuando sea necesario.
RIESGOS DEL SALVADO CELULAR INTRAOPERATORIO
Históricamente, ha habido preocupación sobre el uso de ICS en mujeres embarazadas debido al riesgo teórico de embolia de líquido amniótico (AFE). Anteriormente se creía que era un fenómeno embólico de las células escamosas fetales, AFE ahora se considera una reacción anafilactoide a los antígenos fetales. Los mismos niveles de células escamosas fetales están presentes en la sangre recuperada como se ve normalmente en la sangre materna en el momento de la separación placentaria (13). No se han reportado casos de AFE atribuidos al uso de ICS en obstetricia (5,7,13).
La aloinmunización ocurre cuando una mujer Rhesus negativa crea anticuerpos contra el antígeno D presente en los eritrocitos fetales positivos Rhesus. Todas las madres están expuestas a células fetales durante el parto. La carga de células fetales se debe cuantificar con una prueba de Kleihauer-Betke que luego se puede usar para determinar la dosis materna de inmunoglobulina Anti-D que requiere administración dentro de las 72 horas posteriores al parto..
Otros riesgos con ICS son similares a los de la población quirúrgica general (10), que incluyen hipotensión con el uso de un filtro de agotamiento de leucocitos y riesgo de contaminación bacteriana. La hipotensión asociada con los filtros de agotamiento de leucocitos es rara y se cree que se debe a la liberación de citoquinas de los leucocitos filtrados. Los informes de casos han demostrado que la hipotensión se resuelve cuando se detiene la reinfusión (13). La contaminación bacteriana de las muestras filtradas sin filtrar y después del lavado es mínima (14), y cuando se usa la profilaxis antibiótica, no parece haber un aumento de la morbilidad infecciosa con ICS (15).
EL CIRCUITO DE SALVAMENTO CELULAR
El circuito de recuperación de células contiene un reservorio de recolección, un procesador y una línea de reinfusión (Figura 1). El depósito de recolección puede configurarse independientemente del circuito de reinfusión.
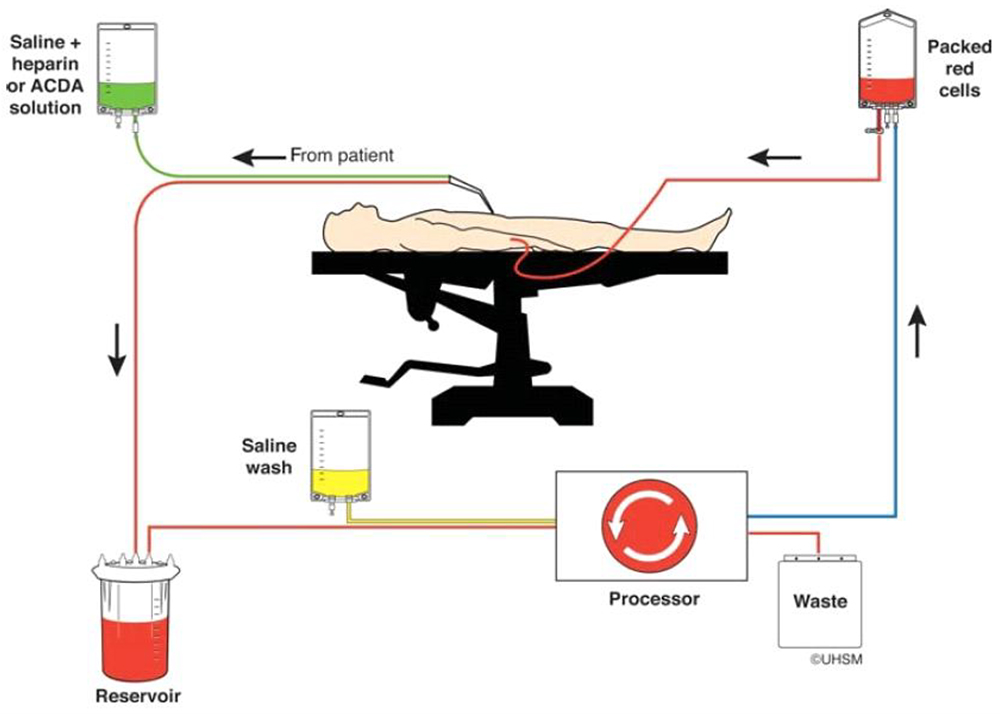
Figura 1. Recuperación de células intraoperatorias (reproducida con permiso del UK Cell Salvage Action Group). 1) Los glóbulos rojos se extraen del campo operatorio y / o frotis. 2) La sangre se hepariniza, se filtra y se lava con solución salina y luego se recoge en un reservorio. 3) Si el volumen de sangre extraída es suficiente, la sangre se procesa mediante centrifugación diferencial, se suspende en solución salina y se vuelve a infundir.
La sangre se extrae del campo quirúrgico con un gran orificio y un sistema de succión a baja presión para minimizar el daño celular. Se puede usar una segunda succión antes de la separación de la placenta para reducir la contaminación con líquido amniótico y meconio. Los hisopos quirúrgicos con sangre se pueden lavar suavemente con solución salina isotónica en un recipiente estéril y el fluido se procesa para optimizar el rendimiento de los glóbulos rojos. La sangre recuperada debe ser anticoagulada durante la recolección, más comúnmente con solución salina heparinizada (16).
La decisión de reinfundir la sangre recolectada se basa en la EBL, la hemoglobina preoperatoria y el escenario clínico. Si hay más de 500 ml de sangre en el reservorio, este suele ser un volumen suficiente para permitir el procesamiento y la reinfusión (aunque este volumen depende del dispositivo). La reinfusión debe ocurrir dentro de las cuatro horas de la recolección.
Si se considera la reinfusión, la sangre recuperada se procesa mediante centrifugación diferencial. La separación se basa en la masa de partículas; Se recolectan eritrocitos más pesados y se desechan el plasma, los factores de coagulación activados, el complemento y las plaquetas. Luego, la sangre se lava, se recoge en una bolsa de reinfusión y se administra al paciente a través de una línea intravenosa (16).
La mayoría de los dispositivos de recuperación de células tienen un filtro estándar de 170-200 micrómetros. También están disponibles filtros de microagregado (40 micrómetros) y filtros de agotamiento de leucocitos. Se colocan entre la bolsa de reinfusión y el paciente. El filtro de agotamiento de leucocitos une el ADN que contiene material celular a un filtro de polietileno para mejorar la eliminación de contaminantes bacterianos, malignos o amnióticos. Los filtros de reducción de leucocitos en teoría disminuyen la contaminación de la sangre recuperada, pero faltan estudios clínicos; se han asociado con mayores tasas de eventos adversos (5).
REFERENCIAS Y ULTERIORES LECTURAS
- Knight M, Callaghan WM, Berg C et al. Trends in postpartum hemorrhage in high resource countries: a review and recommendations from the International Postpartum Hemorrhage Collaborative Group. BMC Pregnancy Childbirth 2009;9:55.
- Mehrabadi A, Liu S, Bartholomew S et al. Temporal Trends in Postpartum Hemorrhage and Severe Postpartum Hemorrhage in Canada From 2003 to 2010. J Obstet Gynaecol Can. 2014;36:21-33.
- The Association of Anaesthetists of Great Britain and Ireland, Obstetric Anaesthetists’ Association. Guideline for Obstetric Anaesthetic Services 2013. https://www.aagbi.org/sites/default/files/obstetric_anaesthetic_services_2013.pdf (accessed on 06/12/2017)
- National Institute for Health & Care Excellence. Guideline IPG144: Intraoperative blood cell salvage in obstetrics. http://www.nice.org.uk/guidance/ipg144 (accessed 26/11/2017)
- Khan, K, Moore P, Wilson M, et al. Cell Salvage and donor blood transfusion during caesarean section: A pragmatic, multicenter randomized controlled trail (SALVO). PLoS Med 14(12):e1002471. https://doi.org/10.1371/journal.pmed.1002471
- Rainaldi M, Tazzari P, Scagliarini G et al. Blood salvage during caesarean section. Br J Anaesth. 1998;80:195–8.
- Corfe J. Joint guideline on the management of intraoperative cell salvage in obstetrics. 2017. Norfolk and Norwich University Hospitals, Norwich, England. http://www.nnuh.nhs.uk/publication/download/cell-salvage-in-obstetrics-jcg0073-v2/ (accessed 10/11/2017).
- Albright C, Rouse D, Werner E. Cost savings of red cell salvage during caesarean delivery. Obstet Gynecol 2014;124:690-696.
- UK Cell Salvage Action Group. Technical factsheets and frequently asked questions (FAQ). https://www.transfusionguidelines.org/transfusion-practice/uk-cell-salvage-action-group/technical-factsheets-and-frequently-asked-questions-faq (accessed 10/11/2017)
- Kuppurao L, Wee M. Perioperative cell salvage. Cont Edu in Anaesth Crit Care Pain 2010;10:104-108.
- Brajtbord D, Johnson D, Ramsay M et al. Use of the cell saver in patients with sickle cell trait. Anesth 1989;70:878-879.
- Taylor RW, Manganaro L, O’Brien J et al. Impact of allogenic packed red blood cell transfusions on nosocomial infection rates in the critically ill patient. Crit Care Med. 2002;30:2249-2254.
- Goucher H, Wong C, Patel S et al. Cell salvage in obstetrics. Anesth Analg. 2015;121:465-468.
- Thomas D. Cell salvage in trauma. Trans Alt Trans Med. 2005;6:31-36.
- Allam J, Cox M, Yentis SM. Cell Salvage in obstetrics. Int J Obstet Anesth. 2008;17:37-45.
- Water J. Intraoperative blood recovery. 2013. ASAIO J. 2013;59:11-17.



