Intensive Care Medicine
Puntos clave
- El SDRA es un síndrome de falla respiratoria hipoxémica asociado a edema pulmonar no cardiogénico qué ocurre en el 10% de los pacientes de cuidado intensivo.
- Se caracteriza por una reacción inflamatoria aguda seguido por una etapa proliferativa. Esto puede progresar ya sea fibrosis o a resolución.
- Los fundamentos para su manejo persiguen evitar exacerbar la injuria pulmonar con una ventilación di volúmenes corrientes bajos con presión controlada el uso apropiado del PEEP y una aproximación permisiva de la hipercarbia.
- Su manejo se acompaña de un manejo conservador de fluidos en casos moderados a severos parálisis neuromuscular y ventilación en posición prona.
- Se puede utilizar ECMO como terapia rescate en casos severos
INTRODUCCION
Descrito por primera vez en 1967, el SDRA es un síndrome de falla respiratoria y proxémica asociada a edema pulmonar no cardiogénico. Es el resultado del daño de la inflamación difusa de los alvéolos y capilares pulmonares como resultado de una injuria local o sistémica. El SDRA hace asocia frecuentemente a la disfunción multiorgánica y tiene una alta mortalidad, morbilidad y costo de atención.
DEFINICION
Su definición previa fue actualizada en el año 2012 con el ánimo de mejorar su precisión y valor predictivo. El SDRA se describe en la definición de Berlín como:
“Una injuria pulmonar inflamatoria aguda y difusa, qué produce un aumento de la permeabilidad la vasculatura pulmonar, aumentó el peso pulmonar y pérdida del tejido ventilado pon hipoxemia y opacidad de bilaterales en las radiografías, asociado con aumento de la mezcla venosa, aumenta el espacio muerto fisiológico y disminución de la distensibilidad pulmonar.”1
Estos son los 4 principales criterios diagnósticos:
- Instauración aguda: en <7 días posterior al desencadenante (por ej. Neumonía)
- Magnitud de la hipoxemia: una PaO2:FiO2 <300 (mmHg0 o <40 (kPa) con al menos 5 mmHg de PEEP
- Infiltrados pulmonares bilaterales en la radiografía o en la tomografía computadorizada
- No atribuible a falla cardiaca o a sobrecarga de fluidos

El SDRA su vez está categorizado en leve moderado y severo de acuerdo con la PaO2/FiO2 (Tabla 1).
EPIDEMIOLOGIA
El estudio LUNG SAFE2 fue un estudio prospectivo observacional Tel epidemiología y manejo del SDRA qué incluyo 29000 pacientes en más de 50 países encontró que los criterios de SDRA sí cumplieron el 10% de las admisiones a cuidado intensivo y el 23% de los casos que requirieron ventilación mecánica. el SDRA fue leve en el 30%, moderado en el 47% y severo en el
23% de los casos. La duración promedio de ventilación mecánica puede 8 días con una mediana de estadía de 10 días. La mortalidad en la unidad de intensivo y en el hospital fue del 34% y 40% respectivamente. El estudio concluyó que el SDRA fue subdiagnosticado y sub tratado con una alta mortalidad.
ETIOLOGIA
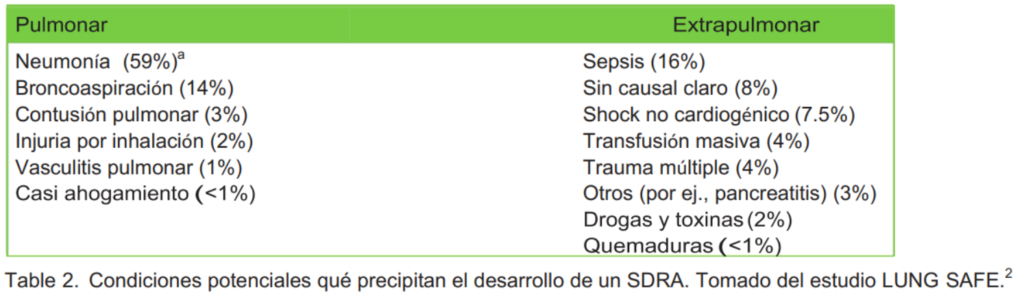
Existen muchas condiciones precipitantes posibles qué pueden ser clasificadas de origen pulmonar extra pulmonar (Tabla 2).
FISIOPATOLOGIA
El SDRA se caracteriza por una respuesta aguda inflamatoria con la liberación de citoquinas como el factor de necrosis tumoral a, IL-1 e IL-6. estos estimulan la migración de neutrófilos hacia los alvéolos. Acá se activan y liberan Formas reactivas de oxígeno que producen una liberación de radicales libres qué lesionan las células endoteliales y los neumocitos. re este daño a los alveolos y endotelio capilar llevan a la acumulación de un exudado inflamatorio rico en proteínas tanto en los alvéolos como el intersticio (“edema pulmonar no cardiogénico”). Las mismas proteínas plasmáticas de natural el surfactante alveolar induciendo colapso alveolar. Los alvéolos colapsados llenos de fluido producen un shunt que desencadena la hipoxemia.
Después de esta fase inicial de inflamación aguda se produce una fase proliferativa( de aproximadamente 72 horas a 7 días)caracterizado por la proliferación neumocitos tipo 2, fibroblastos, y miofibroblastos depositándose una nueva matriz. Esto se continúa con una fase fibra óptica o de resolución y reconstitución de un parénquima pulmonar normal punto la fibrosis intersticial e intraalveolar se produce por depósito desordenado en exceso de colágeno y se asocia a un pobre desenlace, pero los factores que definen la progresión hacia la fibrosis en vez de la resolución aún no se comprenden bien.3
MANEJO: PRINCIPIOS GENERALES
El SDRA es una de las áreas más estudiadas en el cuidado intensivo por lo que existe buena evidencia para su manejo. existen dos importantes guías de manejo en el área: las guías de la American Thoracic Society/European Society of Intensive Care Medicine (2017) y las de Sociedad de Cuidado Intensivo del Reino Unido (2018).4,5
Los principios de manejo si conocen colectivamente como ventilación para la protección pulmonar y se enfocan en minimizar a injuria pulmonar asociada a la ventilación utilizando volúmenes corrientes bajos con presiones controladas, el uso adecuado del PEEP, una fracción de oxígeno racional, y una aproximación permisiva hacia la hipercapnia. se acompaña de estrategia de manejo conservador los fluidos, el uso de bloqueo neuromuscular y la ventilación en posición prona cuando sea indicado.

Estos principios básicos requieren poco equipo especializado por lo que la implementación puede hacerse en cualquier unidad de cuidado intensivo. A pesar de esto y de existir gran cantidad de evidencia que data casi 20 años, el estudio LUNG SAFE encontró que el SDRA se subdiagnosticó (reconocido en apenas el 60% de los casos ) y hubo poca adherencia a las buenas prácticas.
ESTRATEGIAS VENTILATORIAS
Ventilación con volumen corriente bajo
Le esencia del manejo del paciente con SDRA es el uso ventilación con bajos volúmenes corrientes que fue propuesta por el ensayo clínico the ARDSnet trial in 2000.6 Esta estrategia incluye los siguientes:
- Volúmenes corrientes de 6 ml/kg basado en el peso idea
- Presiones de meseta < de 30 cm H2O
- Hipercapnia permisiva tolerada manteniendo un pH superior a 7.2
Los volúmenes corrientes bajos se asociaron a una disminución en la mortalidad y en los días libres de ventilación mecánica. Se considera que el beneficio se logró como resultado de reducir la distensión excesiva o el estiramiento del pulmón aereado qué puede asociarse a la liberación de citoquinas pro inflamatorias que pueden contribuir a la injuria pulmonar (volutrauma) y de otros órganos.
Los obstáculos para la implementación exitosa de estrategia y sus soluciones se discuten en la tabla 3.
El peso ideal en kg se puede calcular a partir de la estatura:
Hombres = 50 + 0.91 (estatura [cm] – 152.4)
Mujeres = 45.5 + 0.91 (estatura [cm] – 152.40
Presión positiva al final de espiración (PEEP)
El PEEP previene el desreclutamiento alveolar, lo que minimiza el atelectrauma. Aumenta la capacidad residual funcional, desplaza fluido de los alvéolos hacia el intersticio, y lleva el pulmón a la zona con mayor pendiente de la curva de distensibilidad. Sin embargo, esto tiene que balancearse contra el riesgo de una hiperinflación y disminución del retorno venoso y por consiguiente del gasto cardíaco.
Encontrar el PEEP específico para cada paciente y determinar su valor óptimo es un reto. Hay una serie de estrategias (ninguna de las cuales ha demostrado ser superior) para encontrar este valor.
- Uso de tablas PEEP/FiO2
- Titulación según la presión de meseta
- Incrementos secuenciales hasta lograr la máxima distensibilida
- Maniobras de reclutamiento seguidas de titulación en decrement
- Basándose en el punto de inflexión de la curva presión volumen
Las guías recomiendan el uso de PEEP elevado( con definiciones variables, pero en general superior a 15 cmH2O) en pacientes con SDRA moderado a severo, en quienes se ha demostrado un beneficio de reducción de la mortalidad ensayos clínicos.
Ventilación en posición prona
Aunque desde hace mucho tiempo se sabe que mejora la oxigenación, su impacto sobre una reducción de la mortalidad fue demostrado hasta hace muy poco. Se han postulado múltiples beneficios fisiológicos: aumento del reclutamiento del tejido pulmonar atelectático dorsal mejorando su la distensibilidad pulmonar (aunque la distensibilidad global no mejore), con una mejor distribución del volumen corriente y una mejora de la relación V/Q. La ventilación en prono también reduce la hiperinflación alveolar, reduce la compresión cardiaca del pulmón subyacente y mejora el drenaje de las secreciones. Hay evidencia experimental que sugiere que puede modifcar la generación y evolución de la injuria pulmonar inducida por el ventilador.7
En años recientes hay evidencia (incluyendo el ensayo clínico fundamental ‘‘Proning severe ARDS patients’’) que demostró una reducción de la mortalidad al ventilar en posición prona por períodos de 12 horas cada día únicamente en el subgrupo de pacientes con SDRA severo.8
Eso debe ser realizado con cuidado y con un entrenamiento adecuado ya que existe un riesgo aumentado tanto de obstrucción del tubo endotraqueal así como desarrollo de úlceras de presión.
Ventilación con liberación de la presión de la vía aérea (ARPV)
La ventilación con liberación de la presión aérea (APRV) a veces llamada “ventilación con relación invertida” es un modo ventilatorio en que la mayoría del periodo del ciclo respiratorio (alrededor del 90%) permanece con presión alta, con una caída breve de la presión para permitir que ocurra la espiración. De manera crucial el tiempo en que se mantiene a baja presión se ajusta sólo para que el flujo espiratorio se reduzca al 70 o 75% de su valor pico lo que evita el desreclutamiento alveolar. La ventilación espontánea sin soporte adicional es deseable.
El raciocinio para el uso del APRV es que la presión media de la vía aérea abre los alvéolos y los mantiene abiertos lo que mejora la oxigenación y disminuye la injuria pulmonar. Es lo que se conoce como el concepto de “pulmón abierto” qué está apoyado por ensayos clínicos pequeños y estudios en animales. La evidencia del uso de APRV en SDRA es aún débil con apenas un ensayo clínico aleatorizado unicéntrico que demostró una mejora del intercambio gaseoso y de los días libre de ventilador en los pacientes con APRV.9 Por esta escasa evidencia ni las guías de la American Thoracic Society ni la de la Intensive Care Society han opinado al respecto.
Ventilación oscilatoria de alta frecuencia
La ventilación oscilatoria de alta frecuencia es un modo ventilatorio usado comúnmente en pediatría en el cual el pulmón se mantiene abierto a presiones medias de la vía aérea elevadas (comúnmente entre 25 y 30 cm H2O) con volúmenes corrientes muy bajos de 1 a 3 ml/kg administrados a una frecuencia entre 3 y 15 Hz. Dos ensayos desfavorables publicados en el 2013 la hicieron perder preferencia al no demostrar diferencias mortalidad entre la ventilación oscilatoria de alta frecuencia y el control en el OSCAR (High Frequency OSCillation in ARDS) y en cambio aumento de la mortalidad en el OSCILLATE (HighFrequency Oscillation in Early Acute Respiratory Distress Syndrome).10,11 Por esta razón las guías recomiendan no utilizarlo en el SDRA.
Maniobras de reclutamiento
Las maniobras de reclutamiento persiguen utilizar un aumento transitorio de la presión ventilatoria para abrir (“reclutar “) alveolos colapsados, revirtiendo la atelectasia que se observa en el SDRA y aumentando el área pulmonar disponible para el intercambio gaseoso. Después de la maniobra de reclutamiento, habitualmente se aumenta el PEEP para mantener abiertos los alveolos recién reclutados. Existen varios métodos propuestos:
- Inflación sostenida( por ej. presión positiva continua de la vía aérea entre 30 y 40 cm H2O por 30 a 40 segundos
- Incrementos secuenciales la presión pico y/o del PEEP
- “Suspiros extendido “en el cual el PEEP se aumenta paulatinamente y el volumen corriente se reduce proporcionalmente para mantener la presión meseta constante. Posteriormente se mantiene una inflación sostenida a una presión continua positiva de la vía aérea de 30 cm H2O y luego la secuencia se hace en reversa para llegar al punto inicial.
Sin duda las maniobras de reclutamiento mejoran la oxigenación y la distensibilidad al menos temporalmente. Sin embargo, pueden inducir inestabilidad hemodinámica y barotrauma y el beneficio fisiológico puede no ser sostenido. Las Guías de la American Thoracic Society dan unas recomendaciones débiles para el uso de maniobras de reclutamiento. Posterior a su publicación en el 2017, el ensayo clínico Alveolar Recruitment for Acute Respiratory Distress Syndrome demostró un aumento de la mortalidad con su estrategia de reclutamiento y titulación del PEEP.2 El beneficio de las maniobras de reclutamiento en la actualidad es incierto.
Oxigenación extracorpórea de membrana (ECMO)
El ECMO requiere el uso de catéteres centrales de gran calibre para remover sangre y pasarla a través de un intercambiado gaseoso y regresarla a la circulación (usualmente venosa). Es una técnica invasiva, costosa y compleja, siendo un método muy efectivo de oxigenación pero que se asocia con múltiples complicaciones. Estas se relacionan con los accesos vasculares, la anticoagulación y el riesgo de sangrado mayor. Como una terapia especializada debe restringirse su uso a los centros de falla respiratoria.
El ensayo CESAR (Conventional ventilatory support vs Extracorporeal membrane oxygenation for Severe Adult Respiratory failure) (2009) demostró una reducción de la mortalidad con el ECMO pero fue criticado por ser un ensayo del uso de buen tratamiento convencional en un centro de falla respiratoria más que un ensayo clínico de ECMO. El problema fue que el 24% de los pacientes asignados a ECMO no recibieron el tratamiento.13 Más recientemente el ensayo clínico EOLIA (ECMO to Rescue Lung Injury in Severe ARDS) (2018) del uso de ECMO para SDRA severo demostró una reducción del 11% de mortalidad en el grupo de tratamiento pero no alcanzó significancia estadística.14 El el ensayo no tenía suficiente poder y además se complicó por la alta tasa de pacientes del brazo control que pasaron a terapia de ECMO. El rol actual del ECMO se circunscribe como terapia de rescate en pacientes con SDRA severo únicamente.

ESTRATEGIAS NO VENTILATORIAS
Terapia conservadora de fluidos
Como el SDRA es un estado patológico de edema pulmonar no cardiogénico, parece obvio el manejo conservador de los fluidos. El ensayo FACTT (Fluid And Catheters Treatment Trial) comparó las estrategias conservadoras y liberales de fluidos y no encontró diferencia en la mortalidad pero hubo significativamente más días libre de ventilador y de estancia fuera de la unidad de intensivo a favor del brazo conservador.15 Por la carencia de evidencia fuerte, las guías dan una recomendación débil a favor del uso conservador de fluidos que aparentemente no se asocia con aumento de la falla renal.
Bloqueo neuromuscular
Los agentes bloqueadores neuromusculares tienen el potencial de mejorar la sincronía entre el paciente y el ventilador al eliminar los esfuerzos de respiración espontánea y la tos. Esto mejora la adherencia a los protocolos de ventilación protectora pulmonar y reduce el barotrauma. Su uso ha demostrado mejorar la oxigenación con el PaO2/FiO2, que además de mejorar el control de la ventilación, puede deberse en parte a una reducción del consumo de oxígeno. Sin embargo, la parálisis requiere sedación profunda que per se genera problemas adicionales. Existe preocupación además de su impacto en favorecer la debilidad muscular adquirida en la unidad de intensivo.
La guía de la Intensive Care Society concluye con revisiones sistemáticas que hay evidencia débil soportando el uso de infusiones de cisatracurio por 48 horas en pacientes con SDRA moderado a severo. Todos los ensayos clínicos se han hecho con cisatracurio, el cual puede tener un efecto antiinflamatorio directo además de su efecto neuromuscular. No es claro si estos hallazgos pueden ser generalizados a otros bloqueadores neuromusculares. En un estudio observacional comparando el cisatracurio con el vecuronio no se encontró diferencia en la mortalidad pero hubo una reducción significativa en los días en ventilación mecánica a favor del cisatracurio.16
Corticosteroides
Debido al componente inflamatorio del SDRA parecería que hubiera un potencial rol para el uso de esteroides para suprimir está fase. Hay múltiples pequeños estudios en esta área muchos de baja calidad y realizados antes el advenimiento de la ventilación protectora pulmonar. La metilprednisolona a un mg/kg/día se recomienda con certeza moderada en el SDRA moderado a severo por las guías de la Society of Critical Care Medicine y de la European Society of Intensive Care Medicine.17
Los esteroides potencialmente pueden aumentar el riesgo de infecciones intrahospitalarias, neuromiopatías y delirium, pero debido a la baja calidad de la evidencia disponible el documento de la FICM (Faculty of Intensive Care Medicine)/Intensive Care Society hace una recomendación indicando la necesidad de más estudios. Es claro que el rol de los esteroides permanece controversial. Hay poca evidencia en esta área y hay ensayos clínicos en proceso.
Otras terapias adjuntas
Múltiples terapias farmacológicas se han ensayado para mejorar la relación V/Q, reducir la injuria inducida por el ventilador y modular los procesos inflamatorios que subyacen el SDRA. La evidencia se resume en la tabla 4.
RESUMEN
El SDRA Es un síndrome de falla respiratoria hipoxémica que se asocia a edema pulmonar no cardiogénico ocurriendo en el 10% de los pacientes de cuidado intensivo. La esencia del manejo está en evitar exacerbar la injuria pulmonar ventilando con volúmenes corrientes bajos, con presión controlada, uso adecuado del PEEP, y una aproximación permisiva a la hipercapnia. Las estrategias adyuvantes incluyen la adopción de una estrategia conservadora de fluidos, y en casos moderados a severos la ventilación en posición prona y el bloqueo neuromuscular. El uso del ECMO puede ser usado como una terapia rescate en los casos severos.
REFERENCIAS
1. The ARDS Definition Task Force. Acute respiratory distress syndrome: the Berlin definition. JAMA. 2012;307(23):2526- 2533.
2. Bellani G, Laffey JG, Pham T, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315(8):788-800.
3. Pierrakos C, Karanikolas M, Scolletta S, et al. Acute respiratory distress syndrome: pathophysiology and therapeutic options. J Clin Med Res. 2012;4(1):7-16.
4. Fan E, Del Sorbo L, Goligher EC, et al. An official American Thoracic Society/European Society of Intensive Care Medicine/Society of Critical Care Medicine clinical practice guideline: mechanical ventilation in adult patients with acute respiratory distress syndrome. AmJ Respir Crit Care Med. 2017;195(9):1253-1263.
5. Guidelines on the management of acute respiratory distress syndrome. The Faculty of Intensive Care Medicine / Intensive Care Society. https://www.ficm.ac.uk/sites/default/files/ficm_ics_ards_guideline_-_july_2018.pdf (accessed on 1/9/19)
6. Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. New Engl J Med. 2000;342(18):1301-1308.
7. Taccone P, Carlesso E, Marini J. Prone position in acute respiratory distress syndrome. Rationale, indications, and limits. Am J Respir Crit Care Med. 2013;188(11):1286-1293.
8. Guerin C, Reignier J, Richard JC, et al. Prone positioning in severe acute respiratory distress syndrome. New Engl J Med. 2013;368(23):2159-2168.
9. Zhou Y, Jin X, Lv Y, et al. Early application of airway pressure release ventilation may reduce the duration of mechanical ventilation in acute respiratory distress syndrome. Intensive Care Med. 2017;43(11):1648-1659.
10. Young D, Young D, Lamb S, Lamb S, Shah S Shah S et al. High-Frequency Oscillation for Acute Respiratory Distress Syndrome. N Engl J Med 2013; 368:806–813
11. Ferguson ND, Ferguson ND, Cook DJ, Cook DJ, Guyatt GH Guyatt GH et al. High-Frequency Oscillation in Early Acute Respiratory Distress Syndrome. N Engl J Med 2013; 368:795 805
12. Cavalcanti AB, Suzumura EA, Laranjeira LN, et al. Effect of lung recruitment and titrated positive end-expiratory pressure (PEEP) vs low PEEP on mortality in patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA. 2017;318(14):1335-1345.
13. Peek GJ, Mugford M, Tiruvoipati R, et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet. 2009;374(9698):1351-1363.
14. Combes A, Hajage D, Capellier G, et al. Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome. New Engl J Med. 2018;378(21):1965-1975.
15. National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network. Comparison of two fluid-management strategies in acute lung injury. New Engl J Med. 2006;354(24):2564-2575.
16. Sottile PD, Kiser TH, Burnham EL, et al. An observational study of the efficacy of cisatracurium compared with vecuronium in patients with or at risk for acute respiratory distress syndrome. Am J Respir Crit Care Med. 2018;197(7):897-904.
17. Annane D, Pastores SM, Rochwerg B, et al. Guidelines for the diagnosis and management of critical illness-related corticosteroid insufficiency (CIRCI) in critically ill patients (Part I): Society of Critical Care Medicine (SCCM) and European Society of Intensive Care Medicine (ESICM) 2017. Intensive Care Med. 2017;43(12):1751-1763.
18. Gates S, Perkins G, Lamb SE, et al. Beta-agonist lung injury trial-2 (BALTI-2): a multicentre, randomised, double-blind, placebo-controlled trial and economic evaluation of intravenous infusion of salbutamol versus placebo in patients with acute respiratory distress syndrome. Health Technol Assess. 2013;17:v-vi,1-87.
19. McAuley DF, Laffey JG, O’Kane CM, et al. Simvastatin in the acute respiratory distress syndrome. New Engl J Med. 2014;371(18):1695-1703.



