Pain Management
问题:
在继续阅读本文之前,请先回答下列问题。答案请参考本文末页,并附有详细解析。对于下列问题,请回答是或否:
- 对于鞘内使用阿片类药物的药效学和机制,以下说法是否正确:
- 阿片类药物通过增加钙离子内流使神经细胞超极化
- 神经细胞更倾向于在阿片类药物结合后传递信号
- 由于芬太尼有较高的神经选择性,所以起效快
- 由于吗啡是亲脂性的所以它起效慢
- 因为芬太尼保持在脑脊液中,所以它的作用时间短
- 对于鞘内应用阿片类药物
- 芬太尼增加运动阻滞时间
- 鞘内应用吗啡对于日间手术来说是安全并且有效的
- 在大的关节置换手术麻醉中,鞘内使用100-200mcg 的吗啡是安全并且有效的
- 在胸科手术麻醉中,鞘内使用吗啡应作为2,3 线选择
- 在腹部大手术中,鞘内使用大剂量的吗啡可以改善预后
- 鞘内使用阿片类药物的不良反应
- 鞘内使用芬太尼可以导致给药后6-8 小时出现延迟性呼吸抑制
- 鞘内使用吗啡所导致的严重呼吸抑制可以通过注射纳洛酮治疗
- 瘙痒可以用抗组胺药物治疗
- 5HT3 拮抗剂有利于治疗由鞘内使用阿片类药物所引起的恶心和呕吐,并且对于减少瘙痒也有额外疗效。
- 尿储留是鞘内应用吗啡剂量依赖的副反应。
主要信息
- 鞘内应用阿片类药物是常用的急性疼痛管理方法。
- 脂溶性阿片类药物如芬太尼,起效迅速但是作用时间短。
- 水溶性药物如吗啡,起效慢,作用时间较长,但是 引起延迟性呼吸抑制的风险更大。
- 其他常见的副反应包括瘙痒、恶心、呕吐和尿潴 留。
- 鞘内应用吗啡大于 300mcg 引起延迟性呼吸抑制的 风险更大。
- 鞘内使用吗啡的患者术后应密切监测 24 小时。
介绍
鞘内麻醉是将局麻药注入鞘内(例如,将药物注入珠网膜 下腔的脑脊液中)进行脊髓阻滞,从而利于手术操作。同样, 可以将阿片类药物单独注入鞘内(例如在腹腔大手术中全麻 时)或者辅助局麻药使用,使得阻滞效果更好,并且延长术后 镇痛时间。本指南的目的是探究鞘内使用阿片类药物的优点和 潜在的副反应。
历史背景
在十九世纪中到后期,当麻醉界不断发展的时候,人们开 始试图将脊髓作为麻醉的靶点。James Leonard Corning 和August Bier 率先使用可卡因进行椎管内阻滞,1898 年,Bier 第一次成功的在Kiel 进行了椎管内阻滞麻醉下的手术1。
据记载,1901 年在巴黎,Nicolae Racoviceanu-Pitesti 第一次通过鞘内注射阿片类药物达到镇痛的目的。然而直到 1970 年代这个领域的工作才真正展开。阿片受体首先被发现存在于脊髓背角,紧接着被证实可以调节伤害性刺激的传入。 值得注意的是,据记载,在1979 年Wang 在8 个行泌尿生殖系肿瘤手术的患者的队列研究中,成功在鞘内使用了吗啡2。
在这个时期,随着报道的增多,关于鞘内应用阿片类药物这方面的研究和综述也稳步增多,这反映了我们的临床经验 的积累和对把脊髓作为镇痛靶点的神经药理认识的提高。
鞘内应用阿片类药物的药理学
作用机制
阿片类药物与分布于脊髓的受体结合的根本作用是减少,甚至阻断伤害性刺激的信号传导。同时也通过影响下行传导 通路来调节位于中脑的痛觉传导,这种信号传导的阻滞是其产生效果不可或缺的机制。值得注意的是,突触前端相较于后 端分布着更多的阿片受体。
阿片受体都是由G 蛋白(Mu, Delta and Kappa)介导,并且通过以下的方式来达到阻断信号传导的:
- 减少突触前膜钙离子进入 → 抑制递质的释放
- 增加突触后膜钾离子外流 → 细胞超极化
- 抑制腺苷酸环化酶 → 抑制递质的释放
因此阿片类药物主要作用是通过减少兴奋性递质的释放(例如谷氨酸盐和 P 物质)和创造细胞不易除极的条件,来减 少伤害性刺激信号的传导。然而,抑制性递质例如甘氨酸和γ-氨基丁酸(gamma amino butytic acid, GABA),也在阿片类 药物介导的镇痛中发挥了作用,尤其是通过激活下行抑制通路。本文不涉及痛觉传导相关的复杂的受体和递质系统。
药效学
通过对不同阿片类药物的药效学成分和它们之间的区别的了解,我们对它们的效果和最棘手的不良反应有了深刻的认 识。与临床最直接相关的特性就是它们的亲脂性。2 下面的表格比较了芬太尼和吗啡这两种常用药物的特性。
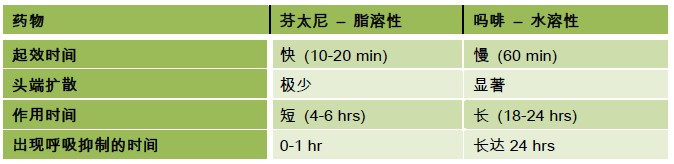
表 1. 脂溶性阿片类药物和水溶性阿片类药物的比较
亲脂性的芬太尼注入脑脊液后将很快扩散到神经组织中,与高亲和力的受体结合迅速起效。然而,这种亲脂性的药物 也会向非神经组织中迅速扩散,如髓鞘和硬膜外脂肪,这会引起药物在脑脊液中的浓度迅速降低,缩短作用时间并且限制 药物向头端扩散。对于吗啡来说则相反,吗啡是亲水性药物,可以在脑脊液中长时间维持浓度,作用时间也较长,并且向 注射点以上扩散,产生的镇痛效果更好。由于其更易向头端扩散,临床上具有能够达到更广泛的镇痛范围的目的。然而, 由于其起效时间较慢,和作用时间较长可能与延迟性的呼吸抑制相关。在鞘内注射阿片类药物理想的情况是选择性的提供 良好得到的镇痛平面,避免因为系统水平阻滞而引起呼吸抑制。然而, Barnards 证明了鞘内使用阿片类药物的镇痛作用 主要来源于它对系统水平的作用,尤其是亲脂类的药物3。
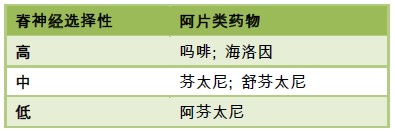
表2. 不同种类阿片药物的脊神经选择性3
鞘内阿片类药物的临床应用
鞘内应用阿片类药物的适应症有很多。我们主要讨论其应用于围术期急性疼痛的管理,并简要地讨论它在慢性癌痛治 疗中的作用。值得注意的是,只有不含防腐剂的阿片类药物才能注射于脑脊液中。
日间手术
日间手术麻醉中,芬太尼是最常应用于鞘内的阿片类药物,它与局麻药有协同作用,并且有提高阻滞和术后镇痛质量 的作用。鞘内使用芬太尼不能延长阻滞时间,不会引起延迟性呼吸抑制。日间手术的患者禁忌在鞘内使用吗啡,因为有潜 在的迟发性呼吸抑制的风险。
大型关节置换术
已经证实对于下肢关节置换手术,作为局麻药的协同剂,鞘内使用吗啡(Intrathecal Morphine, ITM)在是安全有效的。 研究显示,对于髋关节置换术(Toltal Hip Replacements, THR)的患者,鞘内应用100-200mcg 的吗啡可以提高患者的满意 度并且减少PCA 吗啡的 量。主要的临床相关副反应是瘙痒。对于高龄患者,需要根据患者情况将用药剂量调整至有效 范围最小值(例如100mcg) Frassanito 等人证实了,对于行全膝关节置换术(Total Knee Replacements, TKR)的患者, 在鞘内注入吗啡比单次的股神经阻滞更能有效地降低疼痛评分、减少术后补救吗啡镇痛的用量。总的来说,全膝关节置换 对镇痛的要求高于全髋关节置换。然而,许多作者反对在这两种手术患者中ITM 剂量高于300mcg。4, 5 高于300mcg 的剂 量时,发生恶心、瘙痒、尿潴留和呼吸抑制的风险要高于其镇痛收益。
产科手术操作
在剖宫产的患者中,鞘内应用吗啡和芬太尼是十分常见的。常用剂量是在腰麻的局麻药中加入100mcg 的单剂量吗 啡。高于这个剂量的药物会增加发生副反应的风险而不能改善镇痛效果。在一些机构中,同时加入芬太尼作为协同剂。芬 太尼被证实可以减少局麻药的用量并且能够提高阻滞效果。
泌尿科手术
对于泌尿科手术,鞘内应用吗啡被证实的有效剂量是50-300mcg,根据手术操作调整。对于行经尿道膀胱电切 (Transurethral Reasection of Prostate, TURP)的患者,在腰麻的局麻药中加入50mcg 吗啡被证实就能有效减少术后膀胱 逼尿肌痉挛。许多研究表明,鞘内应用吗啡能减少术后24 小时补救镇痛药物的用量。对于肾切除术,300-500mcg 吗啡鞘 内注射被证实能够提供有效的镇痛作用4,5。这些研究都显示,鞘内应用吗啡能够推迟第一次应用镇痛药物的时间。
开腹大手术
鞘内应用吗啡被证实可以降低腹部大手术患者术后24 小时的疼痛评分。然而,术后疼痛往往持续大于24 小时。鞘内 应用吗啡的镇痛效果和阿片类药物节俭效果似乎仅限于第一个24 小时6。有报道显示,鞘内单独应用吗啡可以缩短住院 日,但是这也可能与术后的多模式康复策略相关。ITM 的支持者认为,开腹手术相较于盆腔手术和骨科下肢手术需要更大 剂量的的药物。报道的药物剂量从300-400mcg 到7-10mcg/kg 不等。然而,针对剂量的研究都没有得出明确的、使发生 呼吸抑制等严重副反应风险最低的最佳镇痛剂量。一些研究建议ITM 不能超过300mcg,以避免发生呼吸抑制,但是这个 剂量对于上消化道手术、肝胆手术和主要的肠道手术来说,似乎不能提供有效的镇痛。
开胸手术
对于行开胸手术的患者,相较于单独使用PCA 的患者,在给予静脉PCA 的同时在鞘内给予吗啡能够达到更好的镇 痛效果。然而,胸段的硬膜外镇痛或者是椎旁置管似乎能提供更持久的镇痛效果,且呼吸抑制的风险更低。鞘内应用吗啡 降低视觉模拟疼痛评分(Visual Analogue Scale, VAS)的效果并不优于单次给予扑热息痛和非甾体抗炎药(Non-Steroidal Antiinflammatory Drugs, NSAIDs)。因此,对于胸科手术,当硬膜外麻醉禁忌或在技术上不可行时,推荐ITM 作为椎旁置 管协同镇痛方案或二线镇痛方案。
脊柱手术
研究表明,鞘内应用吗啡对于脊柱大手术的术后镇痛非常有效。Raw 等人推荐在静脉应用PCA 的同时鞘内给予3- 5mcg/kg 吗啡,能够在最大程度降低呼吸抑制风险的同时对这种疼痛剧烈的手术提供有效的镇痛7。
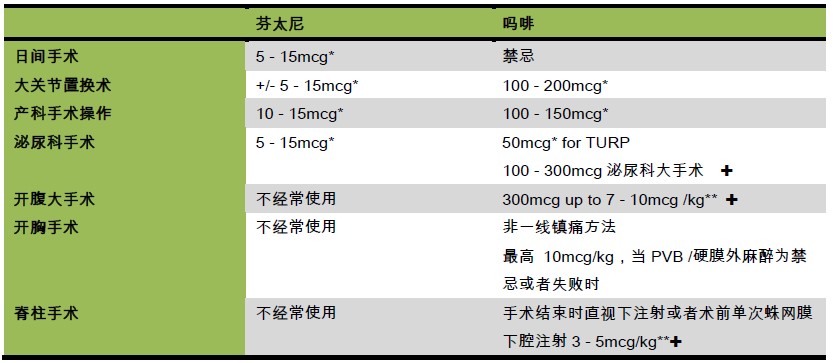
表 3. 对于不同种类手术鞘内使用阿片类药物的推荐剂量. *腰麻时与局麻药同时使用 (TURP= Transurethral resection of prostate,经尿道前列腺电切术, PVB= paravetebral block,椎旁阻滞) ** 任何患者给予 > 300mg ITM 在术后至少24 小 时密切监测是否有呼吸抑制。 ✚为全麻患者围术期镇痛用
慢性癌痛
根据美国癌症协会(American Cancer Society)的报告,高达75%的癌症患者在癌症的不同时期出现疼痛8。这种疼 痛随着病情进展不断加重,并且不会因有效的治疗而减弱。逐渐衰弱所伴随的疼痛往往会引起抑郁,并常常得不到有效处 理。在这种情况下吗啡是最常用的药物,吗啡无效或不能耐受时可以选择氢化吗啡酮代替。对于难治性疼痛,或当患者对 于全身给药的副反应不耐受时,可选择鞘内给药8。给药方案有许多种。许多机构开始时给予单次鞘内注射治疗,或一次 性的短期鞘内置管。之后可能采用皮下隧道以便长时间留置鞘内导管,当需要延长治疗的时间时,还可以植入能够反复填 充药物并改变给药速率的泵装置8。需要通过滴定的方式个体化给药,而推荐剂量并不实用。阿片类可以与低剂量的局麻 药、α受体激动剂(可乐定)、GABA 激动剂(普瑞巴林)或者其他药物(氯胺酮)配合使用。这些用药将不在本文做过 多的介绍。可能出现的相似的副反应在后文中详细介绍。虽然发生率低但也应注意在植入泵部位或者更严重的情况,在蛛 网膜下腔,出现血肿和/或感染。
鞘内注射阿片类药物的并发症
与其他给药途径相同,鞘内给予阿片类药物有良好的镇痛效果,也存在着出现严重副反应的风险。呼吸抑制,尤其是 鞘内给予吗啡产生的特异性的延迟性呼吸抑制,是鞘内应用阿片类药物最可怕并发症。一项大样本的系统分析显示,鞘内 给予吗啡有很高的出现呼吸抑制的风险,OR 值为7.86 和NNH 为15 6。尽管一些患者需要通过给予纳洛酮拮抗来保持足 够的通气,却没有患者因为呼吸抑制需要插管。值得注意的是,这项评估呼吸抑制的研究对象存在异质性,且并不清楚大 于300mcg 时出现呼吸抑制的风险。Jacobsen 等人证实了在鞘内给予1-2.5mcg 吗啡时患者呼吸抑制的发生率为60- 100%。但已发表的文章中,对于呼吸抑制的定义并不统一,使其真实的发生率无法查明。
表1 显示了常规在临床应用鞘内吗啡时呼吸抑制的发生时间和持续时间。这揭示了尽量避免在日间手术中应用鞘内吗 啡的原因。由于呼吸频率和潮气量可能受到不同程度的影响,所以发现呼吸抑制可能比较困难。一些患者可能呼吸频率正 常但是出现二氧化碳蓄积,也有一些患者因潮气量增加,虽然呼吸频率低但二氧化碳分压是正常的2。脉搏氧饱和度监测 可以检测出低氧合的患者,但却不能提示高碳酸血症。然而这些情况与鞘内吗啡剂量高于300mcg 直接相关。因此,对于 无法在术后24 小时内监测血气的患者,鞘内给药不要超过300mcg。出现呼吸抑制危险因素包括:高龄(>65 岁)、鞘内 吗啡用量大于300mcg、同时通过其他途径给予阿片类药物9。根据ASA 的指南,为发现和治疗椎管内阿片用药所引起呼 吸抑制,推荐鞘内给予吗啡后在12 小时内每小时监测一次,12-24 小时内每两小时监测一次。在第一个24 小时之后的监 测频率应根据患者临床情况进行调整9,10。总体来说,患者没有缺氧时,不常规吸入氧气,因为常规吸氧可能掩盖呼吸抑 制并且使二氧化碳浓度升高9。
瘙痒是鞘内应用阿片类药物非常常见的副反应,和其他副反应一样,可能因ITM 而持续很长时间。研究表明,其发生 率为5.1%-85%。由于瘙痒是ITM 造成的,给予抗组胺释放药物来治疗瘙痒的价值有待商榷。有人认为对于这类患者昂丹 司琼是有效的治疗用药。一些研究表明,在ITM 出现瘙痒后,给予2mcg/kg/h 的纳洛酮能够有效缓解症状并且不影响镇痛 效果。另有研究表明亚镇静剂量的丙泊酚治疗此类瘙痒有效。
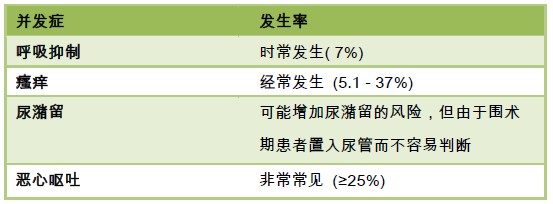
表 4: 鞘内使用阿片类药物的并发症
尿潴留是ITM 常见的并发症,但是在使用亲脂性阿片类药物时不会出现。一项发表在《英国麻醉学杂志》(British Journal of Anaesthesia)的系统性分析表明,在大手术中鞘内单纯应用阿片类药物而不加入局麻药时,尿潴留的发生率会 轻微上升6。未诊断的膀胱膨胀会导致膀胱逼尿肌损伤,故应监测患者尿潴留情况,如发现尿潴留应置入尿管。
与任何途径给予阿片类药物都可引起恶心呕吐。与其他给药途径相比,鞘内给予阿片类药物引起恶心呕吐的发生率是 否更高,目前研究所得出的结论仍然是模棱两可6。脂溶性阿片类药物如芬太尼和舒芬太尼可能不会引起恶心呕吐。鞘内 给予吗啡后恶心呕吐的发生率与全身给药基本相等。因此,应常规进行恶心呕吐的预防和治疗。5HT3 拮抗剂昂丹司琼不 仅可以用来治疗和预防恶心呕吐,还可以减少鞘内给予吗啡所引起的瘙痒。
其他的副反应如镇静作用、胃排空延迟和出汗,并不会比全身用药更严重。
一些其他的研究提倡常规持续输注纳洛酮以减少呼吸抑制和其他副作用。还需要进一步研究来评估既可以减少副反 应,尤其是呼吸抑制,又可以维持镇痛效果的纳洛酮的合适剂量。有关纳洛酮合适剂量的深入研究可能让患者接受大剂量 的鞘内吗啡注射后,在普通病房监护水平下仍保证安全。然而,解决以上问题尚缺乏证据,患者在接受大于300mcg 鞘内 吗啡的第一个24 小时内,仍需要在高医患比例、频繁或持续的监测下进行严密护理。
答案
- 对于鞘内使用阿片类药物的药效学和机制,以下说法是否正确:
- 错误 – 阿片类药物与受体结合可减少钙内流、增加钾外流,后一机制造成细胞超极化。
- 错误 – 受体与阿片类药物结合后使细胞超极化,减少信号传递。
- 错误 – 芬太尼有中等的脊髓选择性。
- 错误 – 吗啡是亲水性阿片类药物,芬太尼是亲脂性的。
- 错误 – 芬太尼是亲脂性的,可以与神经和血管组织结合,其在脑脊液中的浓度迅速降低。
- 对于鞘内应用阿片类药物
- 错误 – 芬太尼可以增强镇痛效果而不延长运动阻滞时间。
- 错误 –因为有发生延迟性呼吸抑制的风险,日间手术禁用鞘内吗啡。
- 正确 –对于髋关节置换来说100mcg 是有效剂量,对于膝关节置换来说 150 – 200mcg 是有效剂量。
- 正确 –对于胸科手术的患者,硬膜外和椎旁置管比ITM 更有效。ITM 联合椎旁置管可作为二线镇痛方案。
- 错误 –降低疼痛评分并减少其他镇痛药物的使用,但不能改善患者预后。
- 鞘内使用阿片类药物的不良反应.
- 错误 –芬太尼会引起早期、短暂的呼吸抑制。
- 正确 – 单次给予纳洛酮作用时间短。因此,在出现严重的呼吸抑制、给予单次纳洛酮后,应开始持续静脉输 注纳洛酮以z防止呼吸抑制复发。
- 错误 – 抗组胺药物不能减轻瘙痒的感觉,却可以引起困倦,因此可以减少抓挠。
- 正确 – 5HT3 拮抗剂被证实可以减轻鞘内使用阿片类药物带来的恶心和呕吐,并且可能会减少瘙痒。
- 错误 –鞘内应用吗啡可增加尿潴留的风险,但不是剂量相关性的。
参考文献与扩展阅读
- Gorelick, P.B. and D. Zych, James Leonard Corning and the early history of spinal puncture. Neurology, 1987. 37(4): p. 672-4.
- Hindle, A., Intrathecal opioids in the management of acute postoperative pain. Continuing Education in Anaesthesia, Critical Care & Pain, 2008. 8(3): p. 81-85.
- Mugabure Bujedo, B., A clinical approach to neuraxial morphine for the treatment of postoperative pain. Pain Res Treat, 2012. 2012: p. 612145.
- Sultan, P., M.C. Gutierrez, and B. Carvalho, Neuraxial morphine and respiratory depression: finding the right balance. Drugs, 2011. 71(14): p. 1807-19.
- Gehling, M. and M. Tryba, Risks and side-effects of intrathecal morphine combined with spinal anaesthesia: a meta-analysis. Anaesthesia, 2009. 64(6): p. 643-651.
- Meylan, N., et al., Benefit and risk of intrathecal morphine without local anaesthetic in patients undergoing major surgery: meta-analysis of randomized trials. Br J Anaesth, 2009. 102(2): p. 156-67.
- Raw, D.A., J.K. Beattie, and J.M. Hunter, Anaesthesia for spinal surgery in adults. Br J Anaesth, 2003. 91(6): p. 886-904.
- Paice, J.A. and B. Ferrell, The management of cancer pain. CA Cancer J Clin, 2011. 61(3): p. 157-82.
- Practice Guidelines for the Prevention, Detection, and Management of Respiratory Depression Associated with Neuraxial Opioid Administration: An Updated Report by the American Society of Anesthesiologists Task Force on Neuraxial Opioids and the American Society of Regional Anesthesia and Pain Medicine. Anesthesiology, 2016. 124(3): p. 535-52.
- Naulty, J.S., The role of intrathecal opiates in the management of acute pain. Clin J Pain, 1989. 5 Suppl 1: p. S16-27.



