POINTS CLÉS
L’acide tranexamique réduit les saignements et réduit les besoins de transfusion sanguine. Il est utilisé dans la gestion des traumatismes majeurs, des hémorragies et en prophylaxie en chirurgie.
La dose standard est de 1 g par voie intraveineuse, sur un minimum de 10 minutes.
Le principal mécanisme d’action est l’activité anti-fibrinolytique. Il possède également des effets anti-inflammatoires et peut aider à atténuer le syndrome de réponse inflammatoire systémique chez les patients cardiaques.
Il n’y a pas eu de preuves d’événements thrombotiques lors de l’utilisation de l’acide tranexamique, mais des préoccupations théoriques demeurent et une prudence est recommandée chez les patients présentant des antécédents récents ou significatifs de pathologie thromboembolique veineuse.
Chez les patients cardiaques, il a été démontré qu’il augmentait le risque de convulsions, et les fabricants déconseillent son utilisation chez les patients présentant des antécédents de convulsions.
INTRODUCTION
L’acide tranéxamique a été introduit dans les années 1960. Il réduit les saignements en inhibant de manière compétitive la fibrinolyse. Il était initialement prescrit pour les saignements menstruels abondants, mais il est maintenant recommandé dans diverses interventions chirurgicales non urgentes pour réduire les pertes de sang, ainsi que pour le traitement des hémorragies majeures. Il a relativement peu de contre-indications, il est bien toléré et peu coûteux à utiliser. En tant que tel, son utilisation continue à se développer dans d’autres spécialités et chirurgies.
L’essai CRASH2 (2010) est la plus vaste étude à ce jour sur l’acide tranexamique, démontrant un bénéfice significatif en termes de mortalité (1,5%) lorsque 1 g d’acide tranexamique par voie intraveineuse, par rapport au placebo, a été administré dans les 3 heures suivant le traumatisme chez des patients traumatisés avec une hémorragie majeure présumée1. Dans l’essai WOMAN (2017), 1 g d’acide tranexamique par voie intraveineuse a été administré pour le traitement de l’hémorragie post-partum entraînant une réduction du nombre de décès dus à un saignement (0,4%), avec un bénéfice en termes de survie accru lorsque l’acide tranexamique est administré dans un délai le plus court possible par rapport à l’apparition d’une hémorragie du post-partum2. L’essai ATACAS (2018) a étudié l’effet de l’acide tranexamique en chirurgie cardiaque et, conformément à l’effet observé dans d’autres spécialités chirurgicales, la perte de sang a été réduite. Des doses relativement élevées (50-100 mg/kg) ont été administrées et le taux de convulsions postopératoires a été augmenté avec l’acide tranexamique par rapport au placebo3. Certains éléments de preuve établissent un lien entre des doses plus élevées et des réductions plus importantes de la perte de sang péri-opératoire, mais aux dépens d’un taux de convulsions accru. L’acide tranéxamique est également couramment utilisé dans les chirurgies orthopédiques sous forme de dose prophylactique de pré-incision de 1 g dans les arthroplasties totales du genou et de la hanche4. La recherche sur des avantages en chirurgie de la colonne vertébrale, pour l’hématome intracrânienne, pour la résection du foie et en pédiatrie est en cours.
Après avoir passé en revue la pharmacologie, les contre-indications et les effets secondaires, cet article examinera l’utilisation de l’acide tranexamique en pratique clinique dans diverses spécialités. Un test en ligne est disponible pour la formation médicale continue par auto-évaluation (FMC). Il est estimé que cela prend 1 heure à compléter. Enregistrez le temps passé et signalez-le à votre organisme d’accréditation si vous souhaitez réclamer des points CME. Un certificat sera remis à la réussite du test. Veuillez vous référer à la politique d’accréditation here.
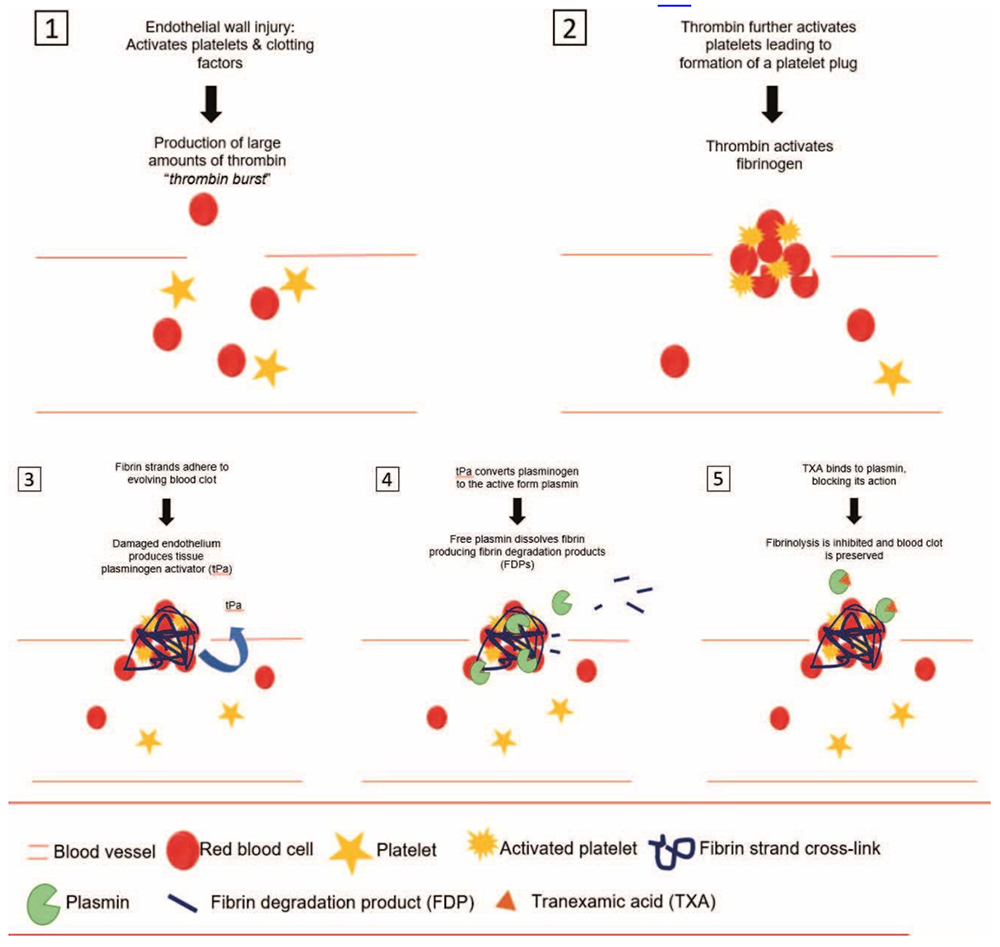
Figure. Les systèmes de coagulation et de fibrinolyse.
FIBRINOLYSE ET MECANISME D’ACTION DE L’ACIDE TRANEXAMIQUE
L’acide tranexamique a des effets bénéfiques sur la fibrinolyse, la fonction plaquettaire et le syndrome inflammatoire systémique5. À la suite d’un traumatisme, d’une intervention chirurgicale ou d’une utilisation de circulation extracorporelle, la capacité du corps à réguler la fibrinolyse locale est dépassée et une fibrinolyse généralisée peut survenir, entraînant une coagulopathie. Le stress de la paroi endothéliale vasculaire active la cascade de la coagulation conduisant à l’activation des plaquettes et à la formation de caillots, à une production importante de thrombine et à des liaisons croisées de fibrine renforçant le caillot sanguin en développement (masse de globules rouges, globules blancs, plaquettes, fibrinogène, fibrine et plasminogène). Pour empêcher la croissance incontrôlée du caillot sanguin, une fibrinolyse est également initiée. La fibrinolyse est activée localement par les activateurs du plasminogène que l’on trouve dans l’endothélium endovasculaire et par les macrophages qui convertissent le plasminogène en plasmine et favorisent la fibrinolyse au site de formation du caillot5.
L’acide tranexamique est un dérivé synthétique de la lysine, un acide aminé, qui inhibe la fibrinolyse en se liant de manière réversible aux sites de liaison à la lysine du plasminogène, empêchant ainsi le clivage de la fibrine5,6. (Voir la figure) La plasmine agit sur les plaquettes pour réduire l’agrégation et l’adhérence des plaquettes. Par conséquent, l’acide tranexamique, en réduisant la formation de plasmine, aide à préserver la fonction plaquettaire5. La plasmine et le plasminogène ont également des effets pro-inflammatoires, notamment l’activation des monocytes et la production de cytokines, tandis que le rôle de l’acide tranexamique dans la réduction de l’inflammation n’est pas complètement élucidé, l’expression de plusieurs gènes pro-inflammatoires est altérée dans le contexte
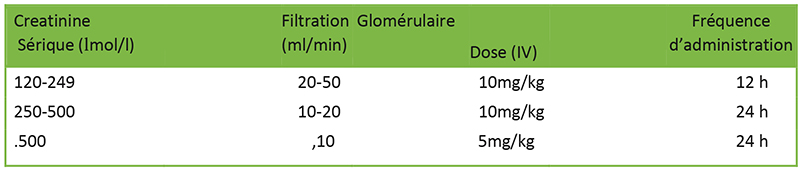
Tableau 1. Dose ajustée à l’insuffisance rénale
cardiaque après l’administration d’acide tranexamique, et il est démontré une réduction du syndrome systémique de réponse inflammatoire et de l’utilisation concomitante des vasopresseurs7. Il a également été démontré qu’il inhibait le complément6.
Il existe peu de preuves que certains patients connaissent un scénario d’arrêt fibrinolytique dans lequel ils augmenteraient leur propre activité d’inhibiteur activateur du plasminogène, et ne bénéficieraient donc pas de l’acide tranexamique, et pourraient devenir pro-thrombotiques si de l’acide tranexamique est administré à ce sous-groupe de patients. La recherche est en cours dans ce domaine et n’a actuellement aucune incidence sur les recommandations cliniques en matière d’utilisation7.
PHARMACOCINETIQUE
Absorption
Les concentrations plasmatiques maximales d’acide tranexamique sont atteintes dans les 3 heures qui suivent une dose orale et l’absorption n’est pas ralentie par un estomac plein. Les pics de concentration surviennent rapidement après l’injection intraveineuse et diminuent de manière multi-exponentielle6.
Distribution
L’acide tranexamique a un volume de distribution de 9 à 12 litres et est lié à 3% aux protéines plasmatiques. Il a une bonne pénétration dans le liquide articulaire et les membranes synoviales, ainsi que pour passer le placenta et la barrière hémato-encéphalique. Tant dans le liquide céphalorachidien que dans l’humeur aqueuse, les concentrations sont égales à 1/10 de celles du plasma avec des concentrations minimales dans le lait maternel (1/100), il est considéré comme sans danger pendant l’allaitement6.
Métabolisme et élimination
L’acide tranexamique est excrété sous forme inchangée dans l’urine et 90% est excrété dans les 24 heures suivant une dose intraveineuse6. Les doses doivent être ajustées en cas d’insuffisance rénale.
Voies d’administration, stockage et compatibilité
Des préparations orales, topiques et intraveineuses existent, mais l’utilisation intra-cérébrale et intrathécale est contre-indiquée en raison de l’activité épileptique chez les animaux. Il a une durée de vie longue de 3 ans et peut être conservé à la température ambiante. L’acide tranexamique par voie intraveineuse est compatible avec les solutions d’électrolytes, de glucose et d’acides aminés ainsi qu’avec l’héparine6. (Voir tableau 1)
Effets secondaires, les convulsions
L’administration d’acide tranexamique topique directement au niveau du système nerveux central chez les animaux provoque des convulsions. Cliniquement, il a été démontré que l’acide tranexamique augmente le risque de convulsions chez les patients subissant une chirurgie cardiaque, en grande partie lorsqu’on utilise des doses modérées et élevées (plus de 10 mg/kg). Les mécanismes de causalité possibles incluent l’inhibition des récepteurs inhibiteurs de la GABA-A et de la glycine conduisant à la stimulation des voies excitatrices, ainsi qu’une susceptibilité accrue des patients cardiaques aux convulsions postopératoires dues aux embolies introduites au cours de la chirurgie3. Un risque accru de convulsions n’a pas été observé dans d’autres situations cliniques. Cependant, les industriels recommandent d’éviter l’utilisation de l’acide tranexamique chez tous les patients ayant des antécédents de convulsions6.
Risque thromboembolique
Il existe un fondement théorique aux préoccupations selon lesquelles l’acide tranexamique pourrait favoriser la formation de thrombus, ce que corroborent des études in vivo sur des animaux montrant une augmentation dose-dépendante du thrombus et un risque thromboembolique7. Cependant, les méta-analyses multiples n’ont pas montré d’augmentation du risque d’infarctus du myocarde, d’accident vasculaire cérébral, d’embolie pulmonaire ou de thrombose veineuse profonde avec l’acide tranexamique par rapport au placebo5,7,8. Par la suite, il est recommandé qu’un accident thromboembolique veineux aigu soit une contre-indication absolue à l’acide tranexamique et une analyse risque/bénéfice doit être entreprise s’il existe des antécédents personnels de pathologie thromboembolique veineuse6 (Voir tableau 2).
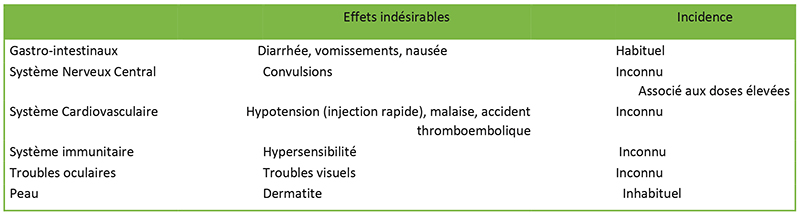
Tableau 2. Effets indésirables de l’acide tranexamique
UTILISATION CLINIQUE
L’acide tranexamique réduit les pertes sanguines chez les patients présentant une fibrinolyse normale ou une hyperfibrinolyse6. Une hyperfibrinolyse peut survenir à la suite d’une intervention chirurgicale, d’un traumatisme, d’une lésion tissulaire ou de l’utilisation d’une circulation extracorporelle où la capacité naturelle du corps à réguler la fibrinolyse locale est dépassée et la fibrinolyse devient systémique, entraînant une coagulopathie. De plus, lors de la formation de caillots, le fibrinogène est consommé rapidement et l’acide tranexamique administré précocèment préserve les réserves de fibrinogène pendant les hémorragies. Par conséquent, les cliniciens devraient avoir pour objectif de prévenir, plutôt que de traiter, la coagulopathie et d’administrer de l’acide tranexamique le plus tôt possible. Il s’agit d’une intervention utile pour la prévention des saignements au cours d’une intervention chirurgicale majeure dans un large éventail d’interventions chirurgicales, réduisant de 34% et 39% les pertes péri-opératoires moyennes de sang et les transfusions ultérieures9. Les transfusions sanguines sont coûteuses et rares, en particulier dans les zones à ressources limitées, et présentent de multiples risques pour les patients, notamment des réactions liées à la transfusion, une immunomodulation et une infection transmissible par transfusion (Voir tableau 3).
Trauma
Les traumatismes sont une cause majeure de décès dans le monde entier, avec une hémorragie causant un tiers des décès hospitalier par traumatisme. Des anomalies précoces de la coagulation, notamment une hyperfibrinolyse, sont fréquentes chez les patients traumatisés et contribuent de manière substantielle à la mortalité. Une vaste étude a montré qu’un g d’acide tranexamique par voie intraveineuse, par rapport au placebo, réduisait le risque de décès par saignement de 15% sans risque accru d’événements indésirables1. Cependant, les bénéfices du traitement diminuent de 10% toutes les 15 minutes de retard après la première heure
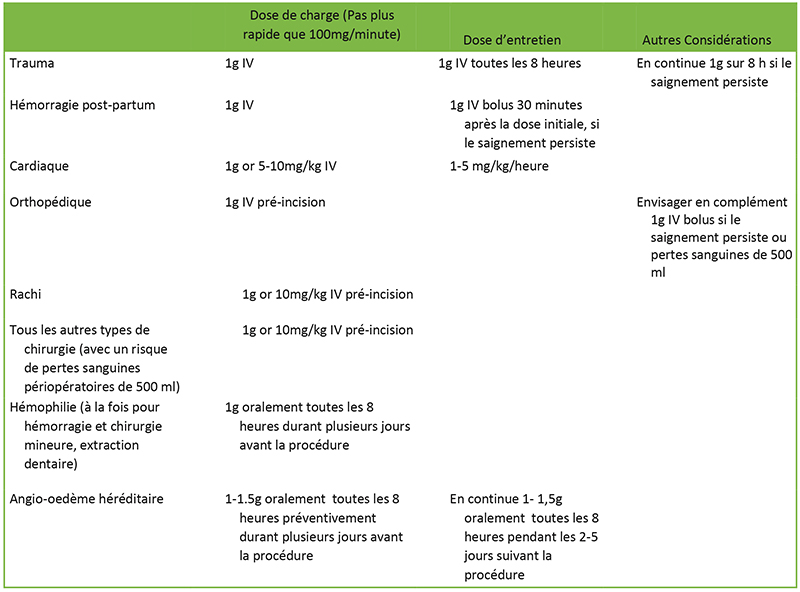
Tableau 3. Tableau résumé des doses
suivant le début de l’hémorragie, et doit donc être administré le plus tôt possible, mais certainement dans les 3 heures. Après 3 heures, il ne devrait pas être administré sauf s’il existe des signes évidents d’hyperfibrinolyse dans les résultats sanguins10.
Obstétrique
L’hémorragie du postpartum est la principale cause de mortalité maternelle dans le monde. Dans l’heure qui suit la naissance, la concentration de plasminogène double, entraînant l’activation de la fibrinolyse. Bien que la perte de sang et le débit de transfusion ne soient pas réduits, l’essai WOMAN a démontré que l’acide tranexamique intraveineux, par rapport au placebo, réduisait le risque de décès hémorragique de près d’un tiers sans augmentation des effets indésirables pour la mère ou le bébé2. Il doit donc être administré sous forme de bolus intraveineux de 1 g le plus près possible du saignement (à la naissance), et une dose intraveineuse supplémentaire de 1 g peut être répétée 30 minutes plus tard si les saignements se poursuivent. Il ne doit pas être administré si plus de 3 heures se sont écoulées depuis la naissance en raison de l’absence de bénéfice du traitement.
Cardiaque
L’acide tranexamique a plusieurs actions bénéfiques chez les patients subissant une chirurgie cardiaque. Ces patients présentent un risque élevé de perte de sang et de transfusion ultérieure, en raison de la nature hautement invasive de la chirurgie cardiaque, de l’anticoagulation à fortes doses et de la perte de sang dans le circuit de dérivation cardiopulmonaire extracorporelle. L’exposition au circuit extracorporel active le système fibrinolytique et provoque un dysfonctionnement des plaquettes. Ainsi, en plus de son activité antifibrinolytique, l’acide tranexamique aide à préserver la fonction plaquettaire pendant la circulation extracorporelle3. Les patients qui subissent une chirurgie cardiaque majeure souffrent souvent d’un syndrome de réponse inflammatoire systémique majeure conduisant à un choc et à une défaillance multi-viscérale. Il a été démontré que l’acide tranexamique modifiait l’expression de plusieurs gènes inflammatoires, atténuant cette réponse inflammatoire5.
L’acide tranexamique réduit le taux de perte de sang, le risque de réopération pour hémorragies (qui entraînent une morbidité et une mortalité accrues), et la nécessité d’une transfusion sanguine sans risque accru de décès ou de complications thrombotiques chez les patients subissant une chirurgie avec CEC ou à coeur battant3. Cependant, cela entraîne un risque accru de convulsions dans une relation dose-dépendante. Par conséquent, de plus faibles doses d’acide tranexamique (5 à 10 mg/kg) sont de plus en plus utilisées dans les centres cardiaques britanniques, ce qui entraîne moins de crises convulsives postopératoires. Les convulsions surviennent généralement quelques heures après la chirurgie et sont de type grand-mal. Ceux qui ont des crises postopératoires sont par la suite plus à risque d’accident vasculaire cérébral ou de décès. Le risque de convulsions est particulièrement élevé chez les personnes âgées, les personnes souffrant d’insuffisance rénale préexistante, et celles qui subissent une opération à coeur ouvert3.
Orthopédie
L’implantation prothétique et l’utilisation d’un garrot active la fibrinolyse, et le saignement est habituel après une arthroplastie. Les patients qui se présentent pour une arthroplastie de la hanche et du genou sont souvent des personnes âgées atteintes de co-morbidités multiples telles que l’anémie et la cardiopathie ischémique, ce qui les rend plus vulnérables à la morbidité et à la mortalité liées au saignement. L’acide tranexamique réduit considérablement la perte de sang lors du remplacement total de la hanche et du genou. L’administration par voie intraveineuse semble apporter le plus d’avantages, mais les préparations orales et combinées topiques/intraveineuses sont supérieures au placebo4. L’acide tranexamique a une excellente pénétration articulaire et son utilisation a été entièrement intégrée dans les protocoles de réhabilitation accélérée d’arthroplastie totale du genou et de la hanche dans de nombreux centres. Un usage similaire est prévu à l’avenir dans tous les types d’arthroplasties majeures.
Hémorragie intra-crânienne
Dans les hémorragies spontanées, l’acide tranexamique peut réduire l’expansion de l’hématome et entraîne moins de décès à 7 jours sans risque accru de convulsions ou d’autres événements indésirables, mais sans amélioration significative des résultats neurologiques ou de la mortalité à 90 jours11. Par conséquent, il n’est actuellement pas recommandé en pratique clinique, mais les résultats d’une étude en cours (STOP-AUST) sur les bénéfices de l’acide tranexamique chez un sous-groupe de ces patients sont attendus, et une méta-analyse de plusieurs petits essais en cours est prévue.
Chirurgie du rachis
La recherche sur la chirurgie de la colonne vertébrale et l’acide tranexamique a en grande partie porté sur de petites études montrant une légère réduction de la perte de sang et des taux de transfusion après l’administration d’acide tranexamique, mais les différences ne sont pas encore statistiquement significatives. Comme il n’y a eu aucun résultat indésirable, parallèlement à un nombre croissant de preuves dans la plupart des autres spécialités chirurgicales, l’acide tranexamique est recommandé dans toutes les chirurgies de la colonne vertébrale comportant un risque de saignement majeur (30% du volume sanguin total estimé) et/ou une chirurgie concernant plus de 3 étages vertébrales.
Autres utilisations
L’acide tranéxamique a été introduit à titre prophylactique dans un large éventail d’autres affections et procédures, notamment les hémophiles subissant une intervention chirurgicale, un oedème de Quincke héréditaire et la prostatectomie. Il doit être utilisé, sauf contre-indication, dans toute autre intervention chirurgicale importante avec un risque de perte sanguine supérieure à 500 ml ou une perte de 10% du volume de sang circulant. Il est également recommandé pour le traitement des saignements importants dus à une hémoptysie et à une hémorragie gastro-intestinale7, 8. Actuellement, un grand essai multicentrique (HeLiX) étudie l’impact de l’acide tranéxamique sur la transfusion sanguine péri-opératoire chez des patients subissant une résection du foie13.
RESUME
L’acide tranéxamique réduit de manière significative les pertes sanguines péri-opératoires dans une grande variété de spécialités chirurgicales et améliore la survie en cas d’hémorragies traumatiques et du postpartum. Chez les patients cardiaques, il comporte un risque de convulsions, en particulier à doses élevées, et peut théoriquement prédisposer à une maladie thromboembolique, mais sur le plan clinique, les effets indésirables observés sont relativement peu nombreux. Il est très efficace et nécessite une formation minime pour être administrée. En tant que tel, l’Organisation Mondiale de la Santé l’ajoute maintenant à la liste des médicaments essentiels. De futures recherches visant à clarifier les schémas posologiques, en particulier chez les populations cardiaques et pédiatriques, ainsi que l’utilisation dans d’autres disciplines chirurgicales et pour l’hémorragie intracrânienne est attendue.
REFERENCES ET LECTURES COMPLEMENTAIRES
- CRASH-2 trial collaborators. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial. Lancet 2010;376:23-3
- WOMAN trial collaborators. Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with post-partum haemorrhage (WOMAN): an international, randomised, double-blind, placebocontrolled trial. Lancet 2017;389:2105-16
- Myles PS, Smith JA, Forbes A, et al. Tranexamic Acid in Patients Undergoing Coronary-Artery Surgery. N Engl J Med 2017;376:136-48
- Fillingham YA, Ramkumar DB, Jevsevar DS, et al. The Efficacy of Tranexamic Acid in Total Hip Arthroplasty: A Network Meta-Analysis. J Arthroplasty 2018;33:3083-3089.e4 https://www.arthroplastyjournal.org/article/S0883-5403(18)30593-X/ fulltext. Accessed September 8, 2018.
- Levy JH, Koster A, Quinones QJ, Milling TJ, Key NS. Anti-fibrinolytic therapy and perioperative considerations. Anesthesiology 2018;128:657-670
- Datapharm electronics Medicines Compendium (eMC). Pfizer Limited Cyklokapron Injection Summary of product characteristics. https://www.medicines.org.uk/emc/product/1077/smpc. Accessed July 2, 2018.
- Ng W, Jerath A, Wasowicz M. Tranexamic acid: a clinical review. Anaesthesiol Intensive Ther 2015;47:339-50
- Kozek-Langenecker SA, Ahmed AB, Afshari A, et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology. Eur J Anaesthesiol 2017;34:332-395
- Henry DA, Carless PA, Moxey AJ, et al. Anti-fibrinolytic use for minimising perioperative allogeneic blood transfusion. Cochrane database of systematic reviews 2011. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858. CD001886.pub4/full. Accessed July 21, 2018.
- Gayet-Ageron A, Prieto-Merino D, Ker K, et al. Effect of treatment delay on effectiveness and safety of anti-fibrinolytics in acute severe haemorrhage. Lancet 2018;391:125-132
- Sprigg N, Flaherty K, Appleton JP, et al. Tranexamic acid for hyperacute primary IntraCerebral haemorrhage (TICH-2): an international randomised, placebo-controlled, phase 3 superiority trial. Lancet 2018;391:2107-15.
- Colomina MJ, Koo M, Basora M, Pizones J, Mora L and Bago J. Intraoperative tranexamic acid use in major spine surgery in adults: a multicentre, randomized, placebo-controlled trial. Br J anaesth 2017;118:380-90
- U.S. National Library of Medicine. Clinical trials.gov. https://clinicaltrials.gov/ct2/show/NCT02261415. Accessed May 22, 2019.



