Cardiothoracic Anaesthesia
Pontos Chave
- Sem a realização de uma troca valvar, pacientes com estenose aórtica possuem péssimo prognóstico.
- Muitas vezes os pacientes idosos não são indicados para cirurgia de troca valvar por possuírem comorbidades e maior mortalidade.
- O desenvolvimento de técnicas minimamente invasivas aumentou as indicações de troca valvar nos pacientes de alto risco.
- As técnicas e considerações anestésicaspara ITVA são semelhantes ás necessárias para os procedimentos minimamente invasivos realizadosem salascirúrgicas híbridas com hemodinâmica.
INTRODUÇÃO
A estenose aórtica é o estreitamento progressivo da válvula aórtica, ela é uma das doenças valvares mais comuns nos países em desenvolvimento. Cuja a causa mais frequente é secundária a artrite reumatoide¹. A apresentação pode ser assintomática durante muito tempo de forma a ocorrerem 25% dos adultos acima de 65 anos¹. Geralmente, para comprometer a hemodinâmica do paciente a válvula precisa possuir uma área menor que 1 a 1,5cm² ².
A classificação da gravidade é decorrente da área valvar e a média do gradiente de pressão. Branda acima >1,5cm² e gradiente menor que<25mmHg. Moderada de 1 a 1,5cm² e gradiente entre 25 a 40mmHg. Severa abaixo <1cm² e gradiente maior que>40mmHg. Muito severa menor <0,6cm² e gradiente acima de 70mmHg³.
A progressão da doença leva o ventrículo esquerdo (VE) a trabalhar com sobrecarga, resultando em hipertrofia concêntricada parede ventricular. São necessárias elevadas pressões intraventriculares para se manter o débito cardíaco, em concomitância ocorre disfunção sistólicae diastólica levando ao aumento da pós carga e redução da contratilidade². Ocorre a tríade clássica de dispneia, síncope e angina, mas síncope e insuficiência cardíaca significam mal prognóstico³.
O tratamento clínico busca o controle das comorbidades,doença coronariana, dislipidemia, angina, hipertensão e insuficiência cardíaca, mas essas medidas não mostraram melhora da sobrevida. Estatinas previnem eventos isquêmicos. Hipertensão e angina são tratadas com beta bloqueadores ou bloqueadores de canalde cálcio e geralmente se utiliza digoxina e diuréticos para a insuficiência cardíaca. Inibidores da enzima conversora de angiotensina podem ser utilizados com cuidado, uma vez excluída obstrução de saída arterial, mas já os nitratos devem ser evitados devido ao potencial de causar hipotensão de forma imprevisível. A sobrevida em um ano de pacientescom estenose aórtica severa e sintomática está entre 50 e 60%, a não ser que haja uma intervenção cirúrgica ou por cateter³.
A troca valvar aórtica por cirurgia (TVAC) vem sendo considerada o tratamento padrão ouro, melhorando a sobrevida e a qualidade de vida dos pacientes. A mortalidade intra-hospitalar e 30 de pós operatório da TVAC é inferior a 3,2%, e a expectativa de vida, após a cirurgia, volta a ser próxima a população controle2, 4.
Em 2003, o European Heart Survey em doença valvar relatou que 31,8% dos pacientes não foram submetidos à cirurgia devido às comorbidades presentes5. As características predominantes nesse grupo foram: disfunção de VE, estenose aórtica severa e idade avançada, apesar de existir dados relativamente bons de sobrevida em pacientes acima de 79 anos5.
O implante transtorácico de válvula aórtica (ITVA), assim como, a valvuloplastia aortica por balão (VAB) são técnicas menos invasivas para o tratamento de estenose aórtica severa, com benefícios de longo e curto prazo respectivamente. A primeira VAB foi realizada em 1983. Infelizmente, os registros mostraram altas taxas de re-estenose. Em 2002, na Universidade de Rouen na França, o Dr. Alain Cribier demonstrou o primeiro caso troca de válvula aórtica percutânea em um paciente de 57 anos com estenose aórtica inoperável6.
Assim como em outras técnicas percutâneas como o reparo endovascular de aneurisma de aorta, o ITVA é preferido em pacientes que são considerados de alto risco operatório ou quando a cirurgia aberta é contraindicada.Uma revisão de 2011 estimou a mortalidade de 16,4% na população de alto risco de TVAC7. Quando foi utilizada a escala da Society of Thoracic Surgeons Predicted Risk of Mortality (STS-PROM), esses pacientes tiveram pontuação maior ou igual a 10. Pacientes com risco semelhantes,selecionados para ITVA, tiveram mortalidade de 7.4% 8.
O ensaio clínico europeu PARTNER em 2011-12 demonstrou que ITVA eratão eficaz quanto TVAC em pacientes de alto risco, possivelmente até melhor, e deveria ser o tratamento padrão em pacientes inoperáveis. Existem diferenças significantes na mortalidade a depender da abordagem utilizada para a ITVA (trans-femoral 5.9%, trans-apical 12.9% e trans-subclavia, 9.7%) 8.
Para pacientes de alto risco e antes inoperáveis surgiram, nos últimos anos como opção de tratamento primário para estenose de aorta,técnicas por cateter trans-torácico. Já foram realizados mais de 200 mil implantes de válvula aórticaem todo o mundo, com bons resultados em comparação à TVAC9. Há relatos de taxas de sucesso próximas a 98% e mortalidade em 30 dias inferior a 5%. Também foram relatadas melhoras sintomáticas e redução no tempo de internação desses pacientes10,11.
As melhorias na tecnologia de materiais é contínua, como também a superação dos desafios inicialmente encontrados. ITVA pode ser realizada com muitas válvulas, mas a Edwards SAPIEN (figura1) e a Medtronic CORE (figura 2) são as mais fortes no mercado. As válvulas estão na segunda geração, com esperança de reduzir as complicações associadas ao seu uso. As indicações de uso foram ampliadas, em que estudos de pequena escala indicam que no futuro essas válvulasterão um papel no tratamento de insuficiênciaaórtica ou quando ocorre falha da bio prótese e a re-operação cardíaca estiver contraindicada6.
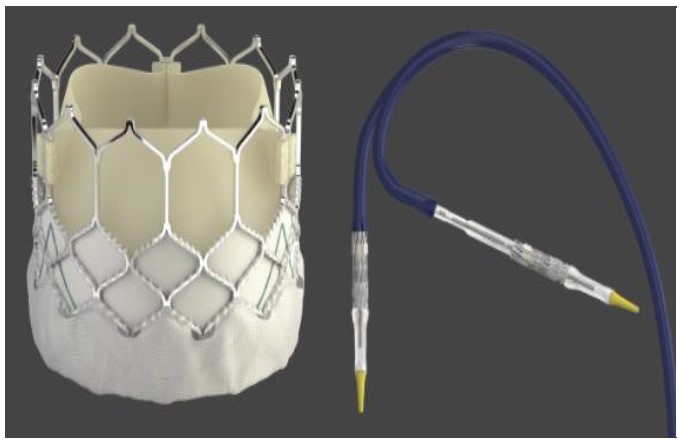
Figura 1. Válvula Edwards SAPIEN 3 comSistema de entrega comandado. Reproduzido com permissão da Edwards Life Sciences.
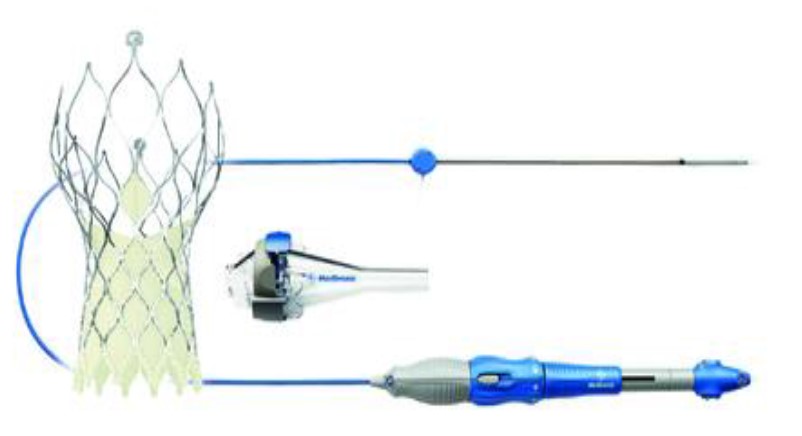
Figura 2. Válvula MedtronicEvolut R com Sistema de entrega. Reproduzido com permissão da Medtronic
Recentemente, há uma tendência em ofertar a ITVA a pacientes de baixo risco ou mais jovens. O ensaio NOTION (Nordic Aortic Valve Intervention Trial) comparou todos pacientes deTVAC com os de ITVA, inclusive os de baixo risco12. Os resultados foram numericamente melhores com o ITVA do que com a TVAC, apesar do estudo ter uma análise fraca de mortalidade12. Assim como qualquer técnica nova, não se sabe os resultados a longo prazo e a durabilidade da válvula também é incerta.
O tutorial a seguir busca focar nas considerações anestésicas do manejo de pacientes submetidos ao ITVA.
INDICAÇÃO E AVALIAÇÃO DE RISCO
Os pacientes são selecionados para ITVA com base dos critérios clínicos e avaliação do risco por uma equipe multidisciplinar de cardiologistas, cirurgiões cardíacos e anestesistas. A EACTS (European Association for Cardiothoracic Surgery) e a ESC (European Society of Cardiology) se posicionam, atualmente, restringindo o ITVA a pacientes de alto risco e aqueles com contraindicação à cirurgia13.
O ITVA e o VAB podem ser utilizados como terapia inicial para estabilizar os pacientes antes de um reparo cirúrgico futuro. O ITVA pode ser utilizado para facilitar a revascularização do miocárdio ou para tratar uma válvula biológica defeituosa. Os guidelines da ESA (European Society of Anaesthesiology) e da ESC falam que o ITVA pode ser considerado em pacientes com estenose aórtica severa, com contraindicação cirúrgica, que necessite de uma cirurgia não cardíaca de emergência13. Isso pode ser útilempacientes que precisem de cirurgia curativa do câncer se tiverem uma expectativa de vida superior há um ano. Esternotomia prévia não é uma contraindicação, inclusive o ITVA é preferível em pacientes revascularizados. Pacientes com insuficiência renal, respiratória ou outras condiçõesclínicas também podem se beneficiar da técnica.
Existem várias contraindicações ao procedimento. Algumas são relativas e sujeitas a mudanças a medida que a técnica for se aperfeiçoando e ocorrerem melhoras na tecnologia das válvulas.

Está em discussão se insuficiência mitral (IM) e IRC dialítica são contraindicações absolutas para ITVA. Uma análise de 316 pacientes submetidos a ITVA eu um centro no Reino Unido, entre 2008 e 2013, encontrou que a IM estava, independentemente, associada com aumento da mortalidade após ITVA14. No entanto, o mesmo estudo observou que houve melhora significante no grau de gravidade da IM do paciente após ITVA, com taxas de mortalidade menores em comparação a pacientes semelhantes com tratamento medicamentoso para IM14. A análise encontrou que pacientes com IM funcional tinham tendência a resultados melhores. Eventos adversos parecem estar associados a IM orgânica, fibrilação atrial concomitante e hipertensão pulmonar15. O foco atual está na avaliação da gravidade da IM, sua causa e sua relação com outras comorbidades, para ajudar, efetivamente, o planejamento e manejo do tratamento do paciente.
Um trabalho de 2012 não encontrou razão para não oferecer ITVA aos pacientes renais crônicos dialíticos15. O tempo de internamento tendeu a ser maior nos pacientes dialíticos. Almeja-se preservar alguma função renal preexistente nos pacientes com IRC estágio 3 a 4. O períodooperatório necessita de diálise adequada e acompanhamento com nefrologista15.


O diagnóstico pré operatório da gravidade da estenose e de acesso vascular adequado para o procedimento pode ser realizado pelo eco-cardiograma trans-torácico e trans-esofágico16. Para acessar a anatomia, o tamanho correto da prótese e a gravidade da doença pode ser realizada a arteriografia da aorta, tomografia computadorizada e angio-ressonância magnética16. Deve-se fazer esforço para identificar e otimizar doenças concomitantes associadas, como insuficiência cardíaca congestiva (ICC).
PLANEJAMENTO DO PROCEDIMENTO
Existem 4 vias para o ITVA: trans-femoral, trans-subclavia, trans-aortica, or trans-apical. A via trans-carotídea foi descrita recentemente na literaturacomo acesso alternativo quando há dificuldade de acesso, mas não é uma via comun17. Cada via apresenta diferentes desafios aos operadores. Não há evidencia que uma via é superior a outra e não há recomendações na escolha da via17. A abordagem é individual, com avaliação cuidadosa por TC observando a distribuição da calcificação dos vasos de acesso, especialmente, a aorta ascendente17.
- A via trans-femoral é a menos invasiva a mais comumente abordada. É necessário que as artérias íleofemorais estejam adequadas, com tamanho igual ou maior que7 mm, com calcificação e tortuosidade mínima16.
- O acesso trans-subclaviaé menos remoto. O acesso aesquerda é preferível.A distância para a colocação da válvula, como também do cateter, é menor. O que evita sangramento no eixo íleofemoral e na aorta toracoabdominal. Isso melhora o controle na soltura da válvula com um posicionamento mais preciso. Isso pode ajudar a reduzir a incidência de vazamento paravalvar e bloqueio átrio-ventricular18.
- As abordagens trans-aorticas ou diretamente na aorta são mais invasivas, por se usar uma pequena esternotomia em J19. As indicações são quando o acesso íleofemoral for ruim ou quando a função do VE for ruim e a via trans-apical estiver comprometida.
- O acesso trans-apical é o mais invasivo, bypassando os vasos arteriais. Possui riscos aumentados de pseudoaneurisma ventricular, romper o átrio, piorar a função do VE, sangramento peri-operatório e complicações respiratórias por causa da toracotomia19. A viatran-apical é útil na presença de aorta em porcelana, o que contraindica a abordagem trans-aórtica. As vantagens são: acesso ilimitado, uma distância menor e uma implantação anterógrada da válvula facilitando o posicionamento17.
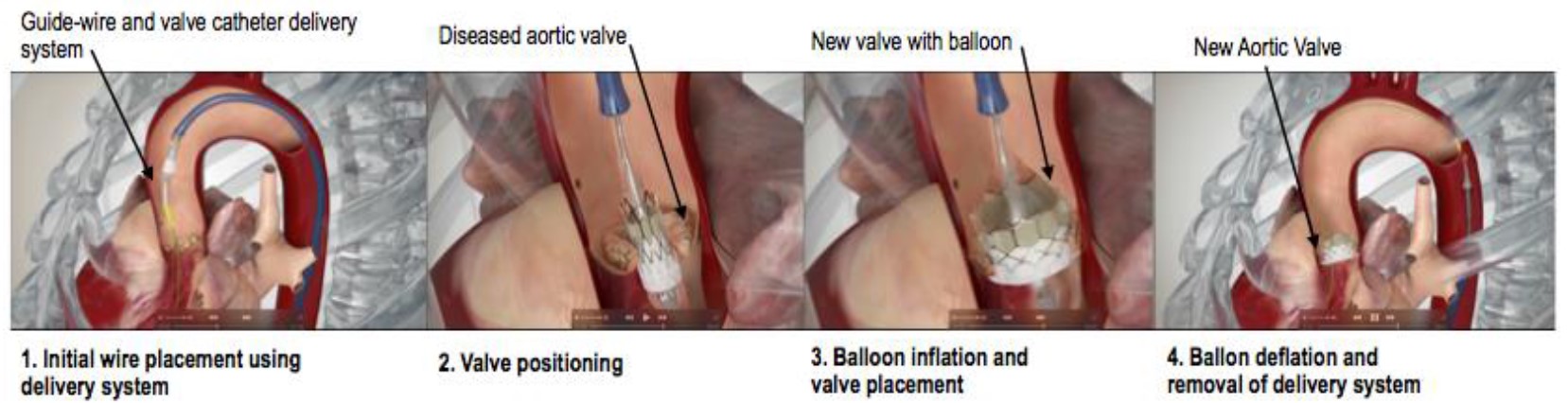
Figura 3.Iustração do procedimento de ITVA. Abordagem femoral utilizando a válvula Edwards SAPIEN 3 Reproduzido com permissão daEdwards Life sciences
Os resultados da via trans-apical são inferiores aos da via trans-femoral, com um aumento do risco de eventos adversos. Isso pode refletir a gravidade de uma doença concomitante que fez necessária essa via mais invasivae não do procedimento em si2.
É essencial que se comunique qual é o plano para gerir eventos inesperados que podem acontecer, como também a limitação da ressuscitação cardio pulmonar precisa estar documentada. Isso pode ser abordado na hora do checklist da pré operatório. ITVA ocorre na sala de hemodinâmica ou idealmente em uma sala cirúrgica híbrida16,19.O ambiente pode ser hostil pela privação de espaço para trabalhar, o que faz a vigilância e organização serem imprescindíveis. Os pacientes podem ter complicações graves, como por exemplo, hemorragia maciça, ruptura de grandes vasos e parada cardíaca. Deve-se ter provisionado acesso a circulação extracorpórea femoral de urgência, desfibriladores, marca-passo e necessidade de intervenção cirurgica16,19.
Precisam estar disponíveis um time de cirurgiões cardíacos e perfusionista, além das considerações seguintes:
- Hemodinâmica: Uso de vasopressors, agentes inotrópicos, marca-passo e desfibrilador4, 16,19.
- Anticoagulação: É necessário um tempo de coagulação ativado (TCA) acima de 250 segundos. A depender da necessidade clínica, AAS e clopidogrel devem ser mantidos no perioperatório4, 16,19.
- Monitorização:É apropriado utilizar monitorização invasiva, eco trans-esofágico e cateteres de pressão de artéria pulmonar4, 16,19. Pacientes acordados são submetidos a eco trans-torácico.
- Circulação Extra-corpórea:Provisionarum bypass cardio pulmonar femoral-femora, especialmente, nos pacientes com fração de ejecção inferior a 20%19.
- Exposição a Radiação: Utiliza-se equipamento de fluoroscopia. Toda a equipe deve está protegida. E deve-se tomar medidas para se evitar lesão renal induzida por contraste4, 16,19.
MANEJO PERI-OPERATÓRIO
Antes da indução, a monitorização padrão com ECG, oximetria de pulso devem ser estabelecidas, assim como monitorização da diurese e temperatura. A monitorização invasiva apropriada está a seguir, os pontos 1 e 2 são recomendados; os pontos 3-5 podem ser decididos caso-a-caso. Cateteres de pressão de artéria pulmonar e dispositivos de assistência ventricular são somente necessários em pacientes de alto risco.
- Acesso venoso periférico calibroso, com um infusor rápido, uma vez a que a perda sanguínea pode ser excessiva..
- Pressão arterial invasiva para responder rapidamente ás mudanças na hemodinâmica.
- Acesso venoso central para administrar vasopressores e suporte inotrópico.
- Um introdutor de cateter de artéria pulmonar, adequado para a inserção do fio de marca-passo temporário, ou inserçãodo própriocateter de artéria pulmonar. O introdutor pode também ser utilizado para infusão rápida16, 19.
- Dispositivo de assistência ventricular para facilitar o procedimento, se a disfunção de VE for importante16.
As metas hemodinâmicas iniciais buscam otimizar a precarga e manter a pressão sistólica e um tempo diastólico adequado. O ritmo sinusal é ideal, buscando 80 bpm com contratilidade adequada. Fibrilação atrial nova é mal tolerada, então é fundamental o controle da frequência. Para se conseguir isso, será necessário o uso judicioso de líquidos, vasopressores e agentes inotrópicos. É preciso ter pressões de enchimento elevadas para encher o VE não complacente. A meta é tratar a hipotensão agressivamente, já que é improvável que RCP seja efetiva sob uma válvula aórtica estenosada.
É improvável que a técnica anestésica esteja associada a diferenças no resultado. Anestesia local e sedação funcionam bem na abordagem trans-femoral. A dor é mínima, com exceção de quando são esticadas as estruturas vasculares. Pacientes submetidos pela abordagem trans-femoral podem ser sedados com fentanil e pequenas doses de midazolam, assim como infiltração local com anestésico. Infusões alvo controladas de Propofol com alvos baixos ou remifentanil também são alternativas adequadas descritas em relato de casos14. As vantagens da sedação são poder avaliar complicaçõesneurológicas prontamente, evitar complicações respiratórias e recuperação rápida com alta hospitalar precoce20.
O objetivo das técnicas regionais é reduzir a necessidade de opioides por evitar excesso de sedaçãocom prejuízo á cognição. Já foram relatados bloqueios do intercostal, paravertebral torácico e peridural nas abordagens trans-apicais4. Na abordagem trans-femoral podem ser realizados bloqueios peridurais lombares e a infiltração da ferida operatória, mas lembrando-se que esses pacientes são heparinizados com TCA de 250 segundos. Deve-se considerar que pode ocorrer necessidade de se instalar a circulação extracorpórea de emergência19.
A grande vantagem da anestesia geral é a imobilidade garantida, especialmente, nos pacientes que não conseguem permanecer em posição supina por muito tempo, permite também um controle melhor das complicações que podem acontecer. O ecocardiograma transesofágico, realizado sob anestesia geral, é superior ao ecocardiograma transtorácico intermitente, o que facilita a entrega e soltura da válvula. O que pode ajudar a diminuir o posicionamento incorreto da válvula e a incidência de vasamento paravalvar no pós operatório4, 21. A incidência de vazamento paravalvar depende de vários fatores, que incluem o tipo de válvula utilizada, a irregularidade da calcificação anular e o tamanho correto do dispositivo. As melhoras observadas na segunda geração de válvulas devem reduzir a incidência dessa complicação6.
A escolha do agente para manutenção da anestesia depende da abordagem e do próprio anestesista. As necessidades anestésicas para ITVA são, geralmente, baixas já que a natureza do procedimento é minimamente invasivo, os pacientes possuem idade avançada, com algum grau de comprometimento renal e baixo débito cardíaco. A analgesia difere da TVAC, por normalmente prescindir de altas doses de opioides, a via trans-femoral precisa de analgesia mínima e as vias trans-aórtica e trans-apical de analgesia moderada4. A mamuntenção é realizada, geralmente, com agentes inalatórios ou TIVA, ambos resultam em uma recuperação rápida.
A recuperação, geralmente, é uma unidade coronariana,mas uma unidade de terapia intensiva (UTI) pode ser necessária, especialmente, nos casos de abordagens trans-apicais e trans-aórtica. A ênfase é na manutenção da função cardíaca, perfusão orgânica com ajuda de inotrópicos ou vasopressores e extubação precoce. Comparada coma cirurgia aberta, espera-se que o ITVA tenha uma recuperação mais curta e menos complicada, com menor tempo de permanênciaem UTI e no hospital.
FASES DO PROCEDIMENTO
São 4 fases e cada uma tem seus próprios desafios para a equipe.
1. Pré-implantação
A obtenção do acesso via artéria femoral e artéria radial direita com um cateter rabo de porco. Um fio de marca-passo trans-venosoé inserido pela veia femoral. Os problemas gravesdesse ponto são, geralmente, relacionados ao sítio da artéria femoral na passagemda valvular dobrada. São passíveis de acontecer: hemorragia, dissecção da artéria e ruptura vascula4, 16,19.
2. Valvulopastia por balão
Algumas válvulas podem precisar de valvuloplastia por balão. Vai depender se a VAB fez parte do tratamento pré operatório entre 4 e 6 semanas antes. A valvular aórtica deve estar dilatada pra garantir a posição da prótese na raiz. A valvuloplastia facilita a passagem da prótese. É realizado sob marca-passo ventricular em frequência de 180 a 220 bpm19. Isso precisa ser mantido por 5 a 10 segundos, pois pode induzir arritmia e isquemia. Existe uma válvula (Lotus), que não precisa dessa rítmica após o posicionamento inicial, mas leva 5 minutos para abrir como um guarda-chuva e essa válvula pode ser recarregada se a posição inicial não for satisfatória. A válvula da Edwards precisa de altas frequênciascardíacas e todo o evento dura entre 6 e 8 segundos. A prática aceita, nesse momento, é administrar pequenos bolus de vasopressores entre as sequencias de ritmo rápido para garantir uma pressão sistólica acima de 75 mmHg. Pode-se utilizar também infusõescontínuas de vasopres4, 16,19.
3. Posicionamento e implantação
Os dispositivos de implantação do balão precisam de ritmo ventricular rápido para reduzir o débito cardíaco, garantirestabilidade no posicionamento e prevenir lesão do miocárdio. Os dispositivos de auto-expansão não precisam de ritmo ventricular rápido, como foi mencionada acima. Na fase de posicionamento, os cateteres de maior diâmetro podem obstruir o fluxo sanguíneo nos vasos que perfundemocérebro, para evitar essa complicação deve-se implantar urgentemente a válvular4, 6,19.
Os problemas dessa fase são16, 19:
- Embolização do dispositivo para dentro da aorta ou VE
- Vazamento paravalvar
- Posicionamento incorreto da válvula
- Obstrução do óstio da coronária
- Arritmia
- Assistolia de VE, atividade elétrica sem pulso, especialmente, em pacientes com função ventricular ruim
- Bloqueio atrio-ventricular
- Choque do folheto da valvular mitral
É muito útil nessa fase usar o ecocardiograma transesofágico, mas o ecocardiograma trans-torácico é o suficiente em pacientes acordados. Ele oferece informações importantes da função do VE, a necessidade de mais dilatação, assegura o posicionamento correto e diagnostica vazamentos paravalvares.
4. Pós implantação
Utiliza-se a angiografia para ver o posicionamento, a função e a situação dos vasos. Os vasos são reparados e o sistema de implantação retirado. Uma vez que a pós carga do VE foi reduzida, o débito cardíaco aumenta e pode-se descontinuar os vasopressores. Pode ser necessário empregar anti-hipertensivos e algumas vezes infusão de nitroglicerina para controlar a hipertensão resultante16, 19.
Se um marca-passo temporário for utilizado, é importante garantir o seu estabilidade e funcionamento. Alguns pacientes, 3 a 7%, precisarão de marcapasso permanente2, 4. Todos os pontos de acesso devem ser monitorados por risco de sangramento. A perda sanguínea pode ser difícil de se dimensionar, especialmente, se for retroperitoneal. Na UTI é mais fácil de se detector hemotórax e tamponamento cardíaco, mas é preciso ter suspeição para se reconhecer essas complicações.
São preditores do desfecho do ITVA a presença de comorbidades e condições do procedimento2, 4,6.A ocorrência de vazamento paravalvar, por calcificação, pode causar insuficiência aórtica. Complicações vasculares podem precisar de intervenção cirúrgica imediata e circulação extracorpórea, isso eleva o risco de mortalidade.
As complicações tendem a comprometer os sistemas cardíaco, neurológico e renais. É comum o paciente ter doença coronariana não revascularizada, portanto pode-se precisar realizar uma revascularização percutânea antes de se evoluir para a troca da valvular. Como foi dito anteriormente, pode ocorrer obstrução do óstio da coronária secundário ao mal posicionamento do dispositivo ou da válvula.
O AVC é uma complicação comum. O registro europeu SAPIEN mostrou incidência de AVC de 2,4%22. Esse risco vem diminuindo, possivelmente, pelo uso de cateteres menores, o que causa menos trauma ou obstrução dos vasos que saem do arco aórtico. A utilização de filtros posicionados no tronco braquiocefálico e artéria carótida comum esquerda reduzem as lesões cerebrais6.
Com relação a funçao renal, os dados do registro mostram aumento da creatinine após o ITVA em 5 a 28% dos casos23. Isso normalmente melhora com o aumento do débito cardíaco, mas existem fatores que contribuem para piora, como o uso de contraste, hipotensão e a necessidade de transfusão sanguínea2.
O seguimento clínico e ecocardiográfico dos pacientes em 5 anos está bem documentado e é raro encontrar falha de folhetos. Somente o tempo dirá se a durabilidade da técnica se assemelha ao das próteses cirurgicas24. Isso é muito importante para se considerar oferecer ITVA aos pacientes mais jovens no futuro12, 25. Suspeita-se que as re-operações desses pacientes daqui a 10 anos não será sem rodeios. O acesso cirúrgico da aorta seria de rotina, mas o grau de fibrose da raiz secundária ao implante pode necessitar de substituição da raiz da aorta, uma cirurgia mais complicada.
CONCLUSÕES
O ITVA é uma técnica bem estabelecida para o tratamento da estenose aórtica em pacientes de alto risco.O progresso da tecnologia e o aumento da experiência com a técnica são rápidos6. A população alvo da técnica é bastante desafiadora e continuará a se beneficiar da abordagem multidisciplinar no perioperatório.
O conhecimento das indicações desse procedimento é importante e relevante aos anestesiologistas. Pacientes com estenose aórtica podem surgir para cirurgias não cardíacas, e é útil o conhecimento dos caminhos de referênciaforados centros terciários de cuidados cardíacos.
As preocupações e considerações anestésicas desse procedimento é semelhante aos outros procedimentos realizados em salas híbridas cirúrgicas e hemodinâmica. Existem semelhanças com os procedimentos neurodiagnósticos e de correção de aneurisma de aorta. A medida que cresça a indicação e evidência desses procedimentos, é provável que anestesiologistas sejam facilitadores do cuidado peri-operatórios nesses ambientes.
PERGUNTAS
Antes de continuar, tente responder as seguintes perguntas. As respostas e explicações estão no fim do artigo. Por favor, responda verdadeiro ou falso:
- Com relação a estenose aórtica:
- É uma das principais causas de doença cardíaca valvar em países em desenvolvimento.
- Está presente em até 30% dos adultos com mais de 65 anos.
- A principal causa de estenose aórtica em países em desenvolvimento é a febre reumática.
- É considerada grave quando a áreavalvar é inferior a 1 cm2.
- Estenose aórtica associada a ICC tem uma mortalidade em 2 anos de 50%.
- Com relação ao manejo clínico da estenose aórtica:
- Geralmente, os nitratos estão contraindicados.
- O tratamento de angina é realizado com beta-bloqueadores ou bloqueadores de canal de cálcio.
- As estatinas reduzem os eventos isquêmicos cardiovasculares em pacientes idosos.
- Não são mais utilizados diuréticos ou digoxina no tratamento quando ICC está associada.
- A ICC associada com estenose é tratada com IECAs.
- As seguintes afirmações sobre o cuidado perioperatório de ITVA são verdadeiras:
- A monitorização arterial invasiva deve ser iniciada antes da indução anestésica.
- Fibrilação atrial, geralmente, é bem tolerada.
- Os pacientes são dependentes de précarga.
- Hipotensão deve ser tratada agressivamente.
- Na ocorrência de PCR, é provável que RCP seja efetiva.
RESPOSTAS DAS PERGUNTAS
- Com relação a estenose aórtica:
- Verdadeiro
- Falso: Está presente em 25% dos adultos acima de 65 anos.
- Verdadeiro
- Verdadeiro
- Verdadeiro
- Com relação ao manejo da estenose aórtica:
- Verdadeiro:Os nitratos irão reduzir a resistência vascular sistêmica, o que irá reduzir a perfusão coronariana.
- Verdadeiro: Ambas substâncias podem ser utilizadas, mas não em concomitância.
- Verdadeiro
- Falso: Ambas substâncias ajudam a melhorar os sintomas da estenose aórtica. A digoxina melhora a contratilidade; diuréticos reduzem o edema pulmonar.
- Verdadeiro: IECAs podem ser utilizados com cuidado.
- As seguintes afirmações, com relação aos cuidados perioperatórios da ITVA, são verdadeiros:
- Verdadeiro: Instabilidade hemodinâmica pode ser detectada e tratada prontamente.
- False: Todo ritmo não sinusal reduz o débito cardíaco. Contrações atriais apropriadas contribuem em até 40% da precarga do VE.
- Verdadeiro: São necessárias pressões de enchimento elevadas para encher o VE não complacente.
- Verdadeiro: A redução na Resistencia vascular periférica reduz a perfusão coronariana.
- Falso:É improvável que a ressuscitação cardiopulmonar seja efetiva através de uma válvula estenótica.
REFERÊNCIAS E LEITURA COMPLEMENTAR
- Chambers, J.B. (2009) ‘Aortic stenosis’, European Journal of Echocardiography, 10(1), pp. i11–i19 doi: 10.1093/ejechocard/jen240.
- Chacko, Matthew, and Laurence Weinberg. “Aortic Valve Stenosis: Perioperative Anaesthetic Implications of Surgical Replacement and Minimally Invasive Interventions.” Continuing Education in Anaesthesia, Critical Care & Pain 12.6 (2012): 295–301.
- Wikipedia. [Place unknown]: Wikimedia Foundation; 2016 Jul 5. Aortic stenosis; Available from: https://en.wikipedia.org/wiki/Aortic_stenosis. (Accessed 10 July 2016)
- Klein, A. A., et al. “Transcatheter Aortic Valve Insertion: Anaesthetic Implications of Emerging New Technology.” British Journal of Anaesthesia (2009) 103.6: 792–799.
- Lung, B. “A Prospective Survey of Patients with Valvular Heart Disease in Europe: The Euro Heart Survey on Valvular Heart Disease.” European Heart Journal (2003) 24.13: 1231–1243.
- Bourantas, C. V., and P. W. Serruys. “Evolution of Transcatheter Aortic Valve Replacement.” Circulation Research (2014) 114.6: 1037–1051.
- Thourani VH, Ailawadi G, Szeto WY, Dewey TM, Guyton RA, Mack MJ, Kron IL, Kilgo P, Bavaria JE. Outcomes of surgical Aortic valve replacement in high-risk patients: A Multiinstitutional study. The Annals of Thoracic Surgery. (2011) Jan; 91(1): 49–56.
- Leon, Martin B., et al. “Transcatheter Aortic-Valve Implantation for Aortic Stenosis in Patients Who Cannot Undergo Surgery.” New England Journal of Medicine (2010) 363.17: 1597–1607.
- Grubb KJ, Fields T, Cheng A, Settles DM, Stoddard M, Flaherty MP. Transaxillary Transcatheter Aortic Valve Replacement with a Self-Expanding Valve under Conscious Sedation: Case Discussion and Review of the Literature. Clin Surg. 2016; 1:1019. http://www.clinicsinsurgery.com/pdfs_folder/cis-v1-id1019.pdf
- Smith, Craig R., et al. “Transcatheter Versus Surgical Aortic-Valve Replacement in High-Risk Patients.” New England Journal of Medicine (2011) 364.23: 2187–2198.
- TAVI: A Solution for All Patients: A Pro-Con Debate at ESC 2015. Medscape. Aug 30, 2015.http://www.medscape.com/viewarticle/850256(Accessed 10 July 2016)
- Vahanian, A., et al. “Guidelines on the Management of Valvular Heart Disease (version 2012): The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS).” European Heart Journal 33.19 (2012): 2451–2496.
- Khawaja, M.Z., Williams, R., Hung, J., Arri, S., Asrress, K.N., Bolter, K., Wilson, K., Young, C.P., Bapat, V., Hancock, J., Thomas, M. and Redwood, S. ‘Impact of preprocedural mitral regurgitation upon mortality after transcatheter aortic valve implantation (TAVI) for severe aortic stenosis’, Heart, (2014) 100(22), pp. 1799–1803.
- Rau, S., Wessely, M., Lange, P., Kupatt, C., Steinbeck, G., Fischereder, M. and Schönermarck, U. ‘Transcatheter Aortic valve implantation in dialysis patients’, Nephron Clinical Practice, (2012) 120(2), pp. c86–c90.
- Jobeir, Med Asaad. Anesthesia for Transcatheter Aortic Valve Implantation. http://www.sha-education.com/sites/all/sha23_presentations/30-1-2012/066002.pdf. (Accessed 10 July 2016)
- Bleiziffer, S., et al. “Which Way in? The Necessity of Multiple Approaches to Transcatheter Valve Therapy”.Current Cardiology Reviews 9.4 (2014): 268–273.
- Petronio A, Carlo M, Giannini C, Carlo F, Bortolotti U. Digital, E and publishing (2013) Subclavian TAVI: More than an alternative access route. Available at: https://www.pcronline.com/eurointervention/S_issue/volume-9/supplement-s/7/subclavian-tavi-more-than-an-alternative-access-route.html (Accessed: 31 December 2016)
- Zhu, Haibei, et al. “Direct Aortic Transcatheter Aortic Valve Implantation: Anaesthesia Attentions.” Proceedings of Singapore Healthcare 24.1 (2015): 59–64. http://psh.sagepub.com/content/24/1/59.full.pdf+html (Accessed 10 July 2016)
- Wiegerinck, E. M. A., et al. “Towards Minimally Invasiveness: Transcatheter Aortic Valve Implantation Under Local Analgesia Exclusively.” International Journal of Cardiology (2014) 176.3: 1050–1052
- Developed by the American Society of Anesthesiologists Task Force on Perioperative Transesophageal Echocardiography, et al. “Practice Guidelines for Perioperative Transesophageal Echocardiography.” The Journal of the American Society of Anesthesiologists (2010) 112.5: 1084–1096.
- Schymik, Gerhard, et al. “European Experience with the Second-Generation Edwards SAPIEN XT Transcatheter Heart Valve in Patients with Severe Aortic Stenosis.” JACC: Cardiovascular Interventions (2015) 8.5: 657–669
- Bagur, R., et al. “Acute Kidney Injury Following Transcatheter Aortic Valve Implantation: Predictive Factors, Prognostic Value, and Comparison with Surgical Aortic Valve Replacement.” European Heart Journal (2009) 31.7: 865–874.
- Early Transcatheter Aortic-Valve Device Durability Comes Under Scrutiny. Medscape. May 31, 2016. http://www.medscape.com/viewarticle/864039(Accessed 10 July 2016)
- Sapien 3 TAVR Superior to Surgery in Intermediate-Risk Aortic-Stenosis Patients, Says Study. Medscape. Apr 05, 2016. http://www.medscape.com/viewarticle/861469(Accessed 10 July 2016)
Figure 1 and 3 reproduced with permission from Edwards Life sciences http://www.edwards.com/eu/Products/TranscatheterValves/Pages/sapien3.aspx?WT.ac=S3campaignprod.
Figure 2 reproduced with permission from Medtronic http://www.corevalve.com/evolut-r/index.htm?loc=corevalve_com_Intl_EvolutR_ContinueToEvoluteRSiteBtn



